
8.4А Основные классы неорганических соединений. Генетическая связь
Раздел:
Тема урока:
Кислоты. Лабораторный опыт № 7 «Изучение свойств кислот»
Цели обучения в соответствии с учебной программой:
8.3.4.8 -знать и понимать классификацию, свойства кислот и составлять уравнения реакций характеризующие их химические свойства
Цели урока:
- Знать классификацию кислот
- Знать окраску различных индикаторов в кислой среде
- Понимать какие соединения относятся к кислотам
- Знать, что кислоты различаются по силе
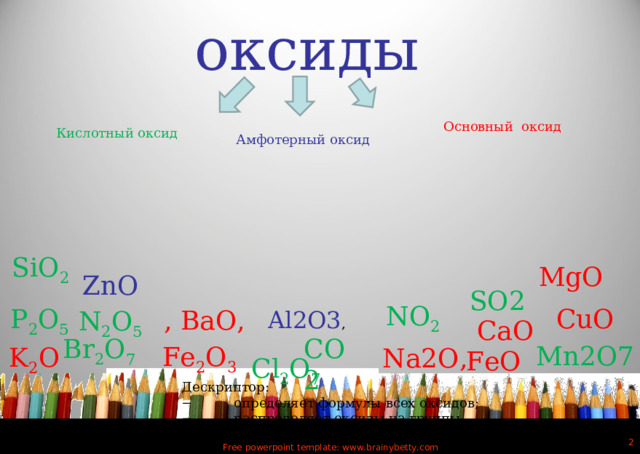
оксиды
Основный оксид
Кислотный оксид
Амфотерный оксид
SiO 2
MgO
ZnO
SO2
NO 2
CuO
P 2 O 5
, ВаO,
N 2 O 5
Al2O3 ,
CaO
Br 2 O 7
CO2
Mn2O7
Fe 2 O 3
K 2 O
Na2O,
FeO
Cl 2 O 7
Дескриптор:
− определяет формулы всех оксидов;
− распределяет оксиды на группы
Free powerpoint template: www.brainybetty.com

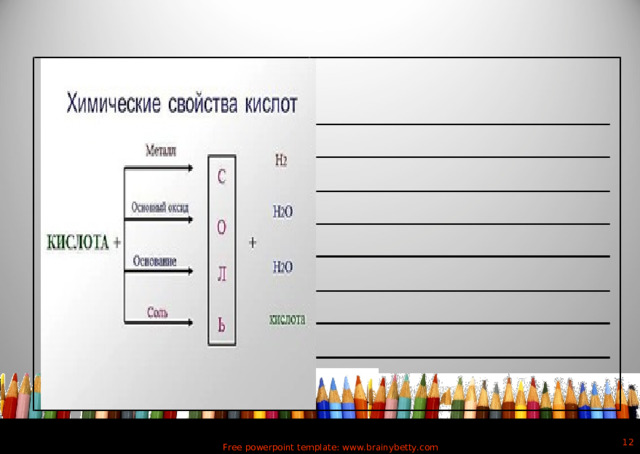
сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов и кислотных остатков
Кислоты:
Кислота=
+
Атом Н
кислотный остаток
=-РО 4
H
H
H
H
- I
H 2
- Br
H 2
-NО 3
H 2
=СО 3
H 2
H
= SiO 3
H 2
-СI
Н 3
Н 2
= S
=SО 4
= SO 3
- F
Free powerpoint template: www.brainybetty.com

кислоты
Кислородсодержащие
Бескислородные
Н 2 SО 4
Н 2 СО 3
НСI
НNО 3
HI
Н 3 РО 4
H 2 SiO 3
HF
H 2 S
H 2 SO 3
HBr
Free powerpoint template: www.brainybetty.com

Free powerpoint template: www.brainybetty.com

Free powerpoint template: www.brainybetty.com

Free powerpoint template: www.brainybetty.com

Выполнение лабораторного опыта № 7 «Изучение свойств кислот»
Опыт 1. Определение среды растворов кислот
Оборудование: соляная кислота, лакмус
Нальем в пробирку соляную кислоту (или раствор серной кислоты).
Добавим 2-3 капли раствора лакмуса (или воспользуемся универсальной индикаторной бумагой, или раствором метилового оранжевого).
Наблюдаемые явления: раствор лакмуса становится красным (универсальная индикаторная бумага приобретает малиновый цвет, метиловый оранжевый - розовеет). Сделайте вывод.
.
Free powerpoint template: www.brainybetty.com

Опыт 2 . Взаимодействие кислот с металлами
Оборудование: соляная кислота, цинк, медь
В две пробирки нальем соляную кислоту (раствор серной кислоты). В одну добавим стружки цинка, а в другую - кусочки медной проволоки.
Наблюдаемые явления: в пробирке с цинком наблюдается выделение бесцветного газа водорода, в пробирке с медью - без изменений. Напишите уравнение реакции и сделайте вывод.
ОПЫТ 3 Взаимодействие кислот с основаниями
Оборудование: гидроксид натрия, фенолфталеин, серная кислота.
В пробирку наливаем 2-3 мл раствора гидроксида натрия.
Добавляем 1-2 капли раствора фенолфталеина.
Наблюдаемые явления: раствор окрашивается в малиновый цвет.
Доливаем в пробирку соляную кислоту (раствор серной кислоты) до обесцвечивания раствора. Наблюдаемые явления: раствор обесцвечивается. Напишите уравнения реакции и сделайте вывод.
Free powerpoint template: www.brainybetty.com

Free powerpoint template: www.brainybetty.com

Free powerpoint template: www.brainybetty.com
Free powerpoint template: www.brainybetty.com

Дом.Задание :. Запишите уравнения возможных реакций .
Карбонат калия + азотная кислота =
Магний + соляная кислота =
Медь + серная кислота (разб) =
Оксид меди (II) + серная кислота =
Азотная кислота + оксид углерода =
Гидроксид натрия + фосфорная кислота =
Цинк + фосфорная кислота =
Оксид серы (IV) + соляная кислота =
Оксид цинка + азотная кислота =
Гидроксид хрома (III) + серная кислота =
Ртуть + серная кислота =
Дескриптор:
-определяет химические свойства кислот и оксидов
Free powerpoint template: www.brainybetty.com

Free powerpoint template: www.brainybetty.com






























