
Электролиз
Цель: изучить сущность процесса электролиза
Задачи:
- раскрыть принцип работы электролизёра
- суть катодных и анодных процессов
- примеры электролиза
- применение электролиза

Электролиз-это окислительно- восстановительные реакции, протекающие на электродах, если через раствор или электролита пропускают постоянный электрический ток.

КАТОД - ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЙ ЭЛЕКТРОД, НА ПОВЕРХНОСТИ КОТОРОГО ИЗБЫТОК ЭЛЕКТРОНОВ.
АНОД - ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННЫЙ ЭЛЕКТРОД. У НЕГО НЕДОСТАТОК ЭЛЕКТРОНОВ.

Катионы активных металлов
Катионы менее активных металлов
Li + , Cs + , K + , Ca 2+ , Na + , Mg 2+ , Al 3+
Катионы неактивных металлов
Zn 2+ , Cr 3+ , Fe 2+ , Cd 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+
Тяжело разряжаются (только с расплавов)
В водном растворе восстанавливаются только металл и водород
Cu 2+ , Ag + , Hg 2+ , Au 3+
Легко разряжаются и восстанавливается только металл
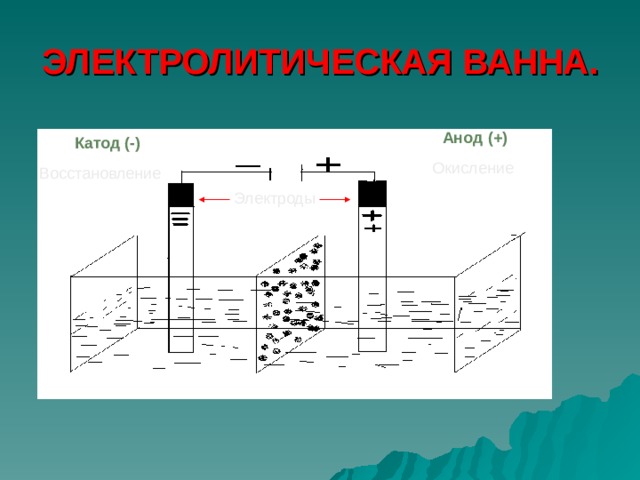
ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.
Анод (+)
Катод (-)
Окисление
Восстановление
Электроды

Процессы на катоде 1.
Катионы активных металлов:
Li + , Cs + , Rb + , K + , Ba 2+ , Ca 2+ , Na + , Mg 2+ , Al 3+ , NH 4 +
Металлы не восстанавливаются, а восстанавливаются молекулы H 2 O :
2H 2 O + 2ē = H 2 ↑ + 2OH –

Процессы на катоде 2.
Катионы металлов средней активности
Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , Co 2+ , Ni 2+ , Sn 2+ , Pb 2+
Катионы металлов восстанавливаются совместно с молекулами воды:
Me n+ + nē = Me o
2H 2 O + 2ē = H 2 ↑+ 2OH –

Процессы на катоде 3.
Катионы водорода H +
Ионы H + восстанавливаются только при электролизе растворов кислот:
2 H + + 2ē = H 2 ↑

Процессы на катоде 4.
Катионы малоактивных металлов:
Cu 2+ , Hg 2+ , Ag + , Pt 2+ , Au 3+
Восстанавливаются только катионы металлов:
Me n + + n ē = Me o

Процессы на аноде 1-2
1) Анионы бескислородных кислот:
I – , Br – , S 2– , Cl –
Окисляются кислотные остатки
A m – – m ē = A o
2) Анионы OH –
Окисляются только при электролизе растворов щёлочей
4 OH – – 4ē = O 2 ↑+ 2H 2 O

Процессы на аноде 3-4.
3) Анионы кислородсодержащих кислот:
SO 4 2– , NO 3 – , CO 3 2– , PO 4 3–
Окисляются молекулы воды:
2 H 2 O – 4ē = O 2 ↑+ 4 H +
4) Анионы F –
Окисляются только молекулы воды
2H 2 O – 4ē = O 2 ↑ + 4H +

Если анод растворимый
- Анод растворимый (активный), изготовлен из Cu , Ag , Zn , Ni , Fe и др. металлы. Анионы не окисляются. Окисляется сам анод:
- Ме о – n ē = Me n +
- Катионы Me n + переходят в раствор. Масса анода уменьшается.

Электролиз расплавов
- Расплав KOH = K + + OH –
- (–) Катод: K + + 1ē = K o
- (+) Анод: 4 OH – – 4ē = O 2 ↑+ 2 H 2 O
- 4 K + + 4 OH – = O 2 ↑ + 2 H 2 O ↑+ 4 K
- 4 KOH → 4 K + O 2 ↑ + 2 H 2 O ↑

1.Соль активного металла и безкислородной кислоты
NaCl ↔ Na + + Cl -
K«катод»(-): Na + + 1e = Na 0
A« анод »(+): Cl - - 1e = Cl 0 ; Cl 0 +Cl 0 =Cl 2
Вывод: 2NaCl → (электролиз) 2Na + Cl 2
2.Соль активного металла и кислородовместительной кислоты
Na 2 SO 4 ↔2Na + +SO 4 2-
K(-): 2Na + +2e=2Na 0
A(+): 2SO 4 2- -4e=2SO 3 +O 2
2Na 2 SO 4 → ( электролиз ) 4Na + 2SO 3 + O 2
3. Гидроксил: активный металл и гидроксид-ион
NaOH ↔ Na + +OH -
K(-): Na + +1e=Na 0
A(+): 4OH - -4e=2H 2 O+O 2

Электролиз растворов солей
- CuCl 2 , раствор
- CuCl 2 → Cu 2+ + 2Cl - ( ЭД)
- Катод: Cu 2+ , H 2 O
- Cu 2+ + 2 e - → Cu 0 ( восстановление)
- Анод: Cl - , H 2 O
- 2 Cl - - 2 e - → Cl 2 0 (окисление)
- Cu 2+ + 2Cl - → Cu 0 + Cl 2 ↑
- 2 CuCl 2 → Cu 0 + Cl 2 ↑ (электролиз)
эл.ток
эл.ток

Электролиз CuCl 2

Электролиз раствора NaCl
- Раствор NaCl
- (–) Катод ← Na + Cl – → (+) Анод
- H 2 O H 2 O
- (–) Катод: 2 H 2 O + 2ē = H 2 ↑+ 2 OH –
- (+) Анод: 2 Cl – – 2ē = Cl 2 ↑
- 2 H 2 O + 2 Cl – = H 2 ↑ + Cl 2 ↑ + 2 OH –
- 2H 2 O+2NaCl=H 2 ↑+Cl 2 ↑+ 2NaOH

Если анод растворимый
- Анод растворимый.
- Электролиз раствора AgNO 3
- (анод растворимый – из Ag )
- (–) Катод: Ag + + 1ē = Ag o
- (+) Анод: Ag o – 1ē = Ag +
- Ag o + Ag + = Ag + + Ag o
- Электролиз сводится к переносу серебра с анода на катод.

Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- На аноде анионы окисляются.
- На катоде катионы восстанавливаются.
(В первой строке все слова начинаются с гласной буквы, во второй - с согласной)

Применение электролиза.
- Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов
- Для получения точных металлических копий, что называется гальванопластикой
- Для защиты металлических изделий от коррозии и для придания декоративного вида. Отрасль прикладной электрохимии, которая занимается покрытием металлических изделий другими металлами называется ГАЛЬВАНОСТЕГИЕЙ.

Электролиз применяется при получении наиболее активных металлов(К, Na,Ca,Mg,Al ), некоторых активных металлов( Cl,F ), а также сложных веществ( NaOH,KOH,KClO ).Электролизом пользуются для покрытий металлических предметов никелем, хромом, цинком, оловом, золотом и тд.














































