ОТКРЫТЫЙ УРОК ПО ХИМИИ В 11 КЛАССЕ
МЕТАЛЛЫ ГЛАВНЫХ ПОДГРУПП
ПРОВЕЛА:
Учитель химии
ГОУ ЛНР « АСШ№8»
Королева Светлана Михайловна
2017
Урок химии в 11 классе
по теме «Металлы главных подгрупп»
Цель занятия: Углубить знания о химических свойствах металлов, развивать умения составлять уравнения химических реакций.
Задачи:
образовательные – углубить знания учащихся об основных химических свойствах элементов-металлов; представление о многообразии металлов; продолжить формировать умения и навыки связывать положение металлов в ПСХЭ Д.И.Менделеева, особенности строения их атомов с химическими свойствами, повторить физические свойства металлов;
развивающие –развивать познавательный интерес, умение логически мыслить, находить и объяснять причинно-следственные связи, прогнозировать; развивать познавательную активность учащихся, вырабатывать умение наблюдать, анализировать, делать выводы, объяснять ход эксперимента;
развивать умение записывать уравнения реакций, характеризующие свойства металлов;
воспитательные – воспитывать коммуникативные качества, умение высказывать собственное мнение, воспитывать самостоятельность в работе, способствовать формированию дисциплинированности, умения слушать, концентрировать свое внимание. поддерживать постоянный интерес к приобретению новых знаний
Требования к знаниям, умениям, навыкам учащимся в соответствии с программой и ГОС.
Требования к знаниям: - знать положение металлов в ПСХЭ, особенности строения их атомов, химические свойства металлов главных подгрупп; варианты классификации металлов.
Требования к умениям: давать характеристику металлов на основании Периодического закона, использовать знания ПЗ и ПСХЭ для объяснения изменений свойств химических элементов и простых веществ на конкретных примерах, на основе положения металла в электрохимическом ряду напряжений металлов делать вывод о возможности протекания химических реакций с водой, кислотами и солями, получить навыки проведения химических реакций.
Планируемый результат:
Знание.
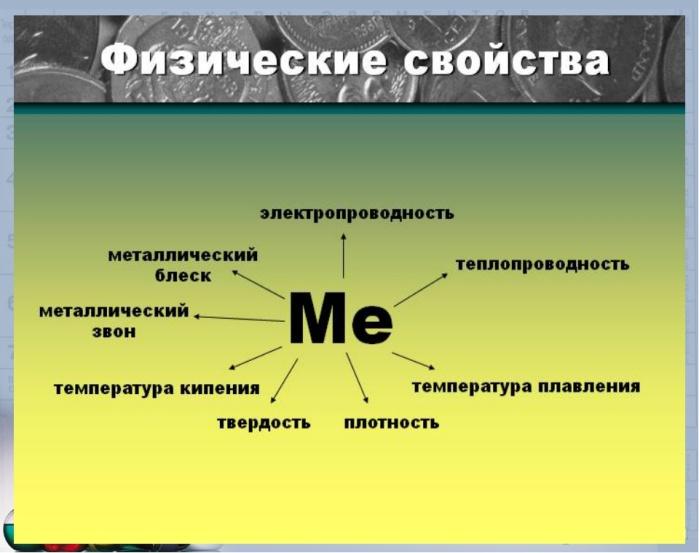
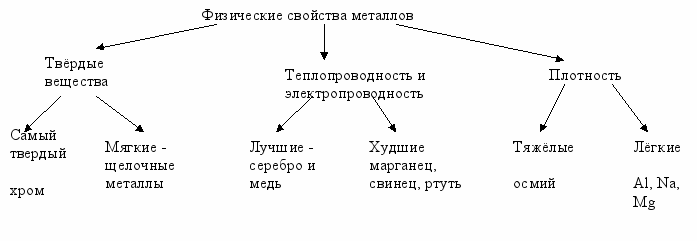
Положение металлов в ПСХЭ, особенности строения их атомов. Повторить и обобщить сведения о металлической связи и кристаллической металлической решётке, общие физические свойства металлов, варианты классификации металлов.
Понимание.
Причину изменения восстановительных свойств металлов в ПСХЭ и физических свойств на основе строения атома.
Применение.
Использовать знания ПЗ и ПСХЭ для объяснения изменений свойств химических элементов и простых веществ на конкретных примерах.
Анализ.
Сравнивает строение различных атомов металлов, анализируя изменения их свойств на основе знаний Периодического закона.
Междисциплинарные связи. Дисциплины: литература, география, физика, биология, история, ИЗО
Внутридисциплинарные связи: Темы «Строение атома», «Строение вещества», «Общая характеристика неметаллов», «Коррозия металлов», «Получение металлов».
Методы обучения:
-словесные (беседа),
-наглядные (инструкции, презентация),
-практические (демонстрационные опыты),
-проблемные (решение проблемных ситуаций)
План урока.
I. Организация урока.
Приветствие, проверка посещаемости
Доброе утро, ребята. Улыбнёмся друг другу! И с хорошим настроением начнем наш урок .Надеюсь урок будет для вас продуктивным, а самое главное – полезным!
Урок я хочу начать словами М. Горького: «Прежде всего и внимательнее всего изучайте химию. Это изумительная наука, знаете…Ее зоркий, смелый взгляд проникает в огненную массу солнца и во тьму земной коры, в невидимые частицы вашего сердца, и в тайны строения камня, и в безмолвную жизнь дерева. Она смотрит всюду и, везде открывая гармонию, упорно ищет начало жизни…»
II. Сообщение темы урока, цели, задач и мотивация учебной деятельности учащихся.
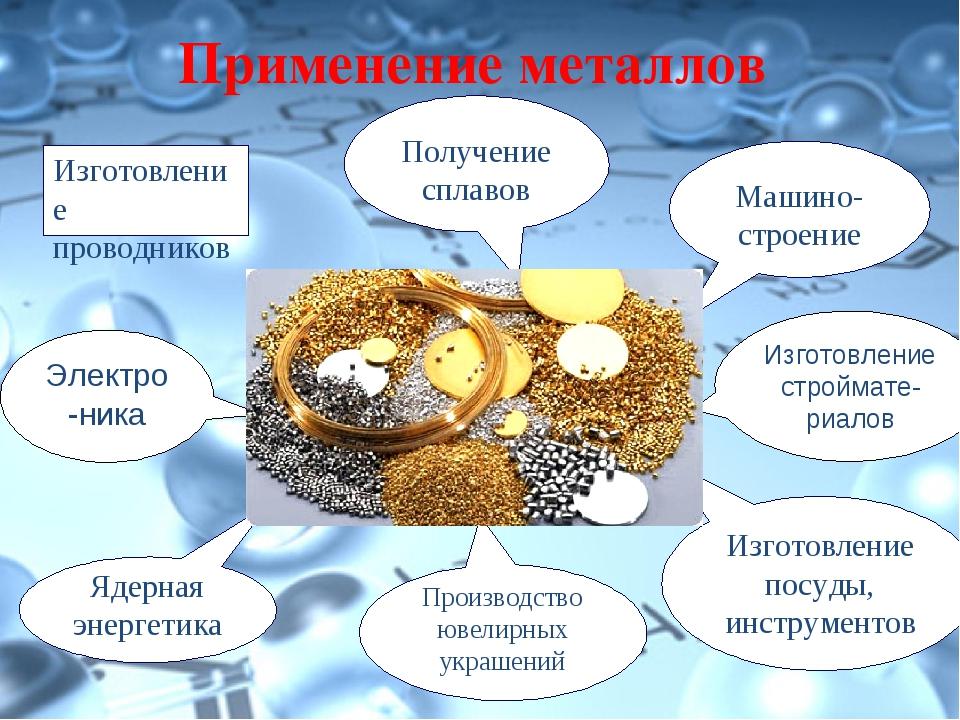
Внимательно осмотритесь вокруг. Где бы вы ни были: дома или в школе, на улице или в транспорте – вы увидите, какое множество металлов трудится вокруг нас и для нас.
Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.
Эпиграфом нашего урока можно взять слова Михаила Васильевича Ломоносова: «Металлы – светлое тело, которое ковать можно».
Именно ковкость и пластичность металлов были важнейшими свойствами, благодаря которым металлы начали активно использоваться человеком. Первые сведения использования металлов в хозяйственной деятельности людей относятся к 4-3 тыс. до н.э. Это время называют медным веком. Затем бронза заменила чистую медь и именно из этого сплава начали изготавливать орудия труда и оружие.
Когда человек научился получать температуру более 1500 °С наступила эпоха изделий из железа и его сплавов – чугуна и стали. Это время стали называтьжелезным веком, начало которого датируют с середины 1 тыс. до н.э. условно можно сказать, что железный век продолжается и по сей день. Ведь примерно 9/10 из всех используемых металлов и сплавов – это сплавы на основе железа. Сегодня мы разбираем свойства металлов главных подгрупп.
III. Стадия вызова. Актуализация ранее усвоенных знаний.
Вспомните, какие вещества мы называем металлами? Составим КЛАСТЕР


IV. Стадия осмысления. Объяснение нового материала.
Основополагающий вопрос. Какие знания о свойствах металлов необходимы человеку?
1.Классификация металлов.
Металлы 1 главной подгруппы называются щелочными –образуют щелочи, 2 группы – щелочно-земельными, из 3 группы изучаем свойства одного из широко применяемых в технике металлов – алюминия.
Атомы щелочных металлов содержат на внешнем энергетическом уровне только 1 электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильными восстановителями.
Строение атома лития и натрия:
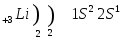
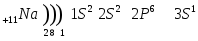
Вот, что говорится об элементах 1 группы главной подгруппы ПСХЭ:
I группа
Электрон на внешнем слое
Еле держится у нас,
Отдаём его спокойно,
Кто захочет, в сей же час.
Мы с водой в соединенье
Щелочи всегда даем,
С хлором, фтором, бромом, йодом
Дружненько в солях живём!
Литий, натрий, калий, цезий, франций
И рубидий заодно,
Нас активней нету, братцы,
Это знают все давно!
СООБЩЕНИЯ УЧАЩИХСЯ О МЕТАЛЛАХ ДАННОЙ ГРУППЫ
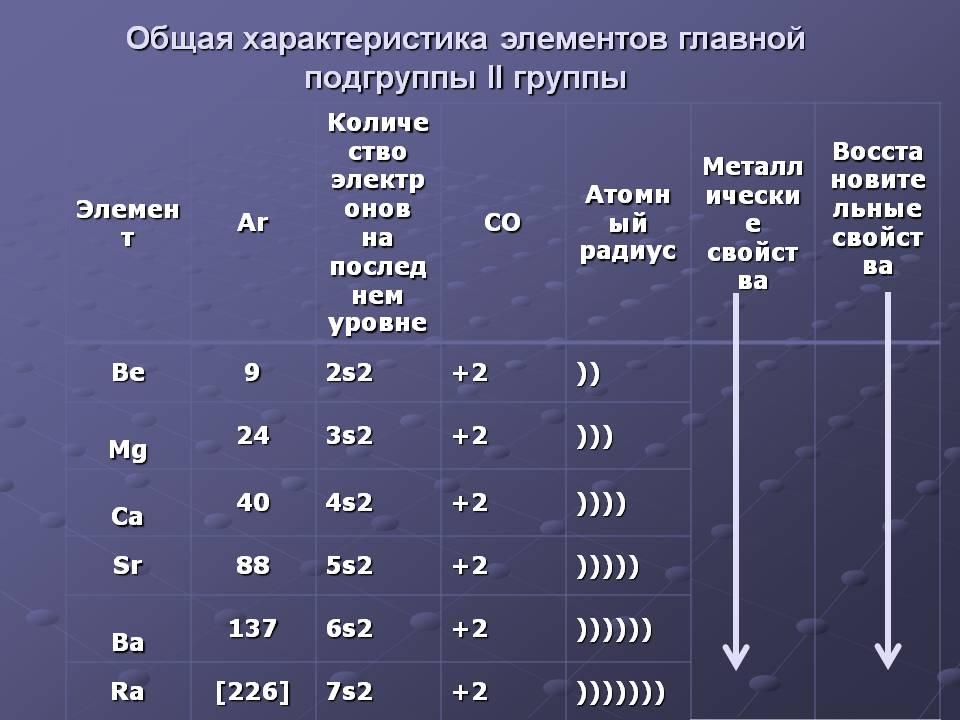
Следующие за щелочными металлами элементы составляют главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью. Са, Sr, Ba, Ra – щелочноземельные металлы.
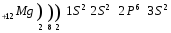
II группа
Мы идём за первой следом,
И валентность наша два,
Без стесненья, скажем смело –
О нас добрая молва.
Средь химического братства
Народ мы очень дружный:
Бериллий, магний, кальций,
Стронций, барий, радий.
С нами трудно состязаться,
Каждый из нас в жизни архиважный,
Каждый из нас в жизни архинужный!
СООБЩЕНИЯ О МЕТАЛЛАХ ЭТОЙ ГРУППЫ – КАЛЬЦИЙ, БАРИЙ
Решение задачи. Найти массу осадка сульфата бария (BaSO4), который образуется при взаимодействии 15 грамм 5% раствора хлорида бария (BaCl2) с сульфатом натрия (Na2SO4).
К металлам относятся и элементы главной подгруппы III группы, исключая бор.
Из элементов главных подгрупп следующих групп к металлам относят:
в IV группе – германий, олово, свинец;
в V группе – сурьма и висмут;
в VI группе – полоний.
Элементы побочных подгрупп – все металлы.
2.Химические свойства металлов.
Зная строение металлов, можно предвидеть их общие химические свойства.
В атомах металлов на внешней электронной оболочке находятся электроны, которые легко отрываются от атомов.
Наиболее общим химическим свойством металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются сильными восстановителями.
2.1.Взаимодействие с простыми веществами: кислородом, галогенами, серой, азотом, водородом.
Реакции с кислородом.
4 Nа + O2 → 2 Nа2O; (побочный продукт)
Взаимодействие с галогенами.
2К + Cl2 →2 КCl;
Взаимодействие с серой.
2K + S → K2 S;
Са + S → СаS;
Взаимодействие с азотом.
6К + N2 → 2K 3 N;
Взаимодействие с водородом (щелочные металлы).
2К + Н2 → 2КН
Обратите внимание, что в этих реакциях атомы металлов отдают электроны, т.е. являются восстановителями, а неметаллы принимают электроны, т.е. являются окислителями.
Вывод: Запомните, металлы реагируют с галогенами, кислородом, серой, азотом, водородом, образуя соединения ……иды. В реакциях с неметаллами металлы являются восстановителями.
Давайте теперь рассмотрим с вами взаимодействие металлов со сложными веществами.
2.2. Взаимодействие со сложными веществами.
2.2.1.Взаимодействие металлов с водой.
При каких условиях металлы вступают в реакцию с водой? (При обычной температуре и при нагревании).
Что образуется при взаимодействии воды с активными металлами при обычной температуре? (Образуется гидроксид и выделяется водород).
Обсуждаем, какой металл реагирует более активно с водой? Почему? С чем это связано? (Положение в ПСХЭ, чем больше радиус, тем активнее металл).
2Na + H2O → 2NaOH + H2 ↑.
Ca + 2H2O → Ca(OH)2 + H2 ↑.
Как вы думаете, почему натрий более активно взаимодействует с водой, чем кальций? (Натрий более активный металл, чем кальций. Он легко отдает свои валентные электроны, является самым сильным восстановителем).
При взаимодействии воды с менее активными металлами образуются оксиды металлов и выделяется водород. Это металлы, стоящие в ряду напряжений после алюминия. Составляем уравнение реакции взаимодействия цинка с водой.
Zn + H2O → ZnO + H2 ↑;
Скажите пожалуйста, все ли металлы взаимодействуют с водой? (Нет).
Совершенно верно. А почему? (см. электрохимический ряд напряжения).
Скажите, а будет ли золото взаимодействовать с водой? (Нет).
Почему? (В ЭХ ряду после водорода) .Медь, ртуть, серебро, платина, золото с водой не реагируют!
Au + H2O → реакция не идет
Запомните! Металлы, стоящие в электрохимическом ряду напряжений до алюминия (включительно) образуют с водой гидроксиды, от алюминия до свинца – оксиды. Остальные с водой не реагируют.
2.2.2. Взаимодействие металлов с растворами кислот.
Мg + 2HCl → Мg Cl2 + H2 ↑;
Запомните! Металлы стоящие в электрохимическом ряду напряжений до водорода могут вытеснять водород из растворов кислот. Металлы стоящие в электрохимическом ряду напряжений после водорода не могут вытеснять водород из растворов кислот.
Cu + H2SO4 → не реагирует.
Какой же вывод можно сделать из этого? С помощью преподавателя находят правильные ответы на поставленные вопросы, делают выводы.
Итак, ряд поправок:
1. правило соблюдается, если в реакции металла с кислотой образуется растворимая соль;
2. концентрированная серная кислота и азотная кислота любой концентрации реагируют с металлами по особому, при этом водород не образуется;
3. на щелочные металлы правило не распространяется, т.к. они легко взаимодействуют с водой.
Вывод: из уравнений реакций видно, что в них окислителями являются ионы водорода и ионы неметаллов, а атомы металлов – восстановители.
2.2.3. Взаимодействие металлов с растворами солей.
Показываем, какие металлы вытесняют из солей по ряду напряжений металлов.
Fe + CuSO4 → Cu + FeSO4
Запомните! В электрохимическом ряду напряжений металл, стоящий левее, может вытеснять из растворов солей металл, стоящий правее (записываем в тетрадь).
Исключение: металлы до магния не могут вытеснять другие металлы из растворов солей, так как в первую очередь реагируют с водой, образуя щелочи.
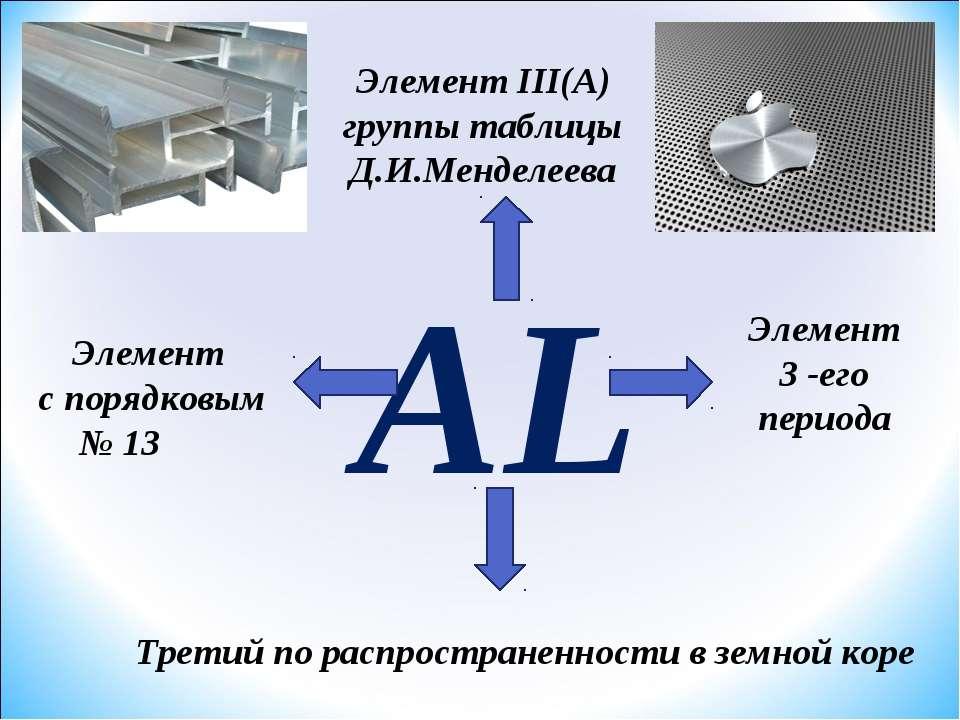
3.Свойства алюминия: Главное, ребята, вес удельный мой,
Потому в дюралях я главный составной,
Назван я «крылатым», так как самолёты
Надежно, легко отправляю в полёты.
« Я металл, серебристый и лёгкий,
И зовусь самолётный металл,
И покрыт я оксидною плёнкой,
Чтоб меня кислород не достал».
Взаимодействие с кислородом.
4Al + 3O2 → 2Al2O3; (при нагревании)
Взаимодействие с галогенами.
2Al + 3Br2 → 2AlBr3; (при нагревании)
Взаимодействие с серой.
2 Al + 3S = Al 2S3 (при нагревании)
Взаимодействие с азотом
2 Al + N2 = 2Al N (при нагревании)
С водородом непосредственно не реагирует.
Поскольку алюминий проявляет амфотерные свойства, то он реагирует и с кислотами и с щелочами, образуя соли. Является активным металлом, поэтому также реагирует и с водой. Почему в быту алюминий не проявляет свойства активного металла?» (поверхность алюминия покрыта оксидной пленкой).
Совершите превращение : Al → Al2O3 → AlCl3 → Al(OH)3→ Al2(SO4)3
Устно перечисляем рекомендации повару, связанные с темой «Металлы».
Не варить кислое в посуде из алюминия.
Не чистить алюминиевую посуду шкуркой, не кипятить содовый раствор.
Не использовать эмалированную посуду с отбитой эмалью
Заботиться о сохранении витаминов и минеральных веществ при варке овощей, мяса итд.
НАХОЖДЕНИЕ В ПРИРОДЕ
В основном встречаются в виде следующих соединений: поваренная соль- NaCl, сильвинит-KCl*NaCl, глауберовая соль-Na2SO4*10H2O, СaCO3 –мел, мрамор, известняк, CaSO4*2H2O-гипс, MgCO3*CaCO3 –доломит. Силикаты:2MgO*4SiO2*H2O –тальк, CaO*MgO*4SiO2- асбест.
Al из всех металлов самый распространенный в природе. Он входит в состав силикатов(шпаты, слюда).а также глин, образующихся из полевых шпатов при их естественном разрушении. Из соединений Al наибольшее значение имеют- Al2O3-корунд, рубин, сапфир.
V.Закрепление материала
Задание. На западе Франции, в Бретани, улитки стали обгрызать краску с наружных стен домов, заползая на высоту до четырех метров. Попытайтесь объяснить этот факт и предложить варианты решения проблемы.
Ответ. Улиткам требуется кальций, идущий на построение раковины. Если заменить меловую краску краской на масляной основе, то проблема, по-видимому, будет решена
Задание. Художники-реставраторы отмечают, что картины, написанные масляными красками, очень быстро тускнеют. Особенно белая краска со временем приобретает серый оттенок, что, естественно, влияет на качество картины. Что же происходит с белыми красками на воздухе и как это можно предотвратить?
Ответ. Белый пигмент — это свинцовые белила. Это вещество представляет собойкарбонат свинца (II). Он реагирует с сероводородом, содержащимся в воздухе, образуя сульфид свинца (II) соединение черного цвета:
РЬСО3 + H2S = PbS + H2COs
Если же обработать накопившийся PbS пероксидом водорода, то образуется сульфат свинца (II) - соединение белого цвета
PbS + 4Н202 = PbS04 + 4Н20
Таким способом можно реставрировать почерневшие картины, написанные маслом.
Совершить превращение: Ba → BaO → Ba(OH)2 → BaCO3 → Ba(NO3)2
Рефлексия
Повторим и запомним:
1. Щ.Ме(Li, Na, K, Rb,Cs ,Fr) образуют главную подгруппу I группы и обладают наиболее выраженными Ме свойствами. Это обусловлено строением атомов Щ.Ме, наружный энергетический уровень которых имеет конфигурацию ns1. Каждый период начинается Щ. Ме. В подгруппе от Li к Fr радиусы атомов увеличиваются, восстановительные свойства усиливаются. Наиболее распространенным Ме из данной группы является Na и K.
2. К главной подгруппе II группы относятся Be, Mg, Ca ,Sr и Ba .
Ca ,Sr и Ba называются щелочно-земельными металлами. Имеют конфигурацию ns2.
Наиболее распространенным Ме из данной группы является Ca.
3. К главной подгруппе III группы относятся B, Al, Ga, In иTl. Наружный энергетический уровень которых имеет конфигурацию ns2np1.
Al амфотерный металл. Образует амфотерный оксид и гидроксид.
Наиболее распространенным Ме из данной группы является Al
Составить фишбоун «Значение металлов»
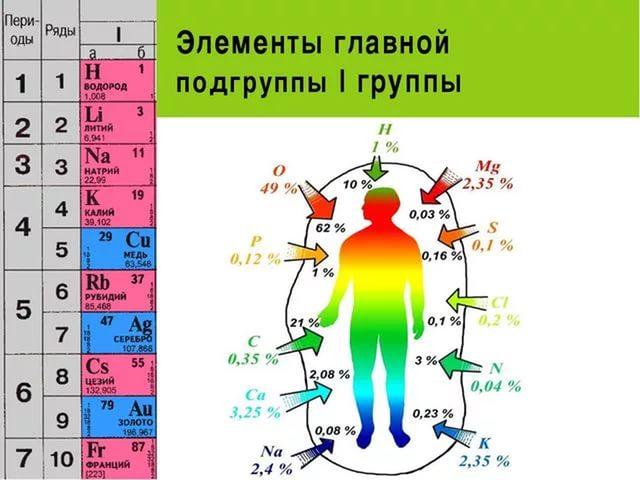
В организме человека растворимые соли натрия входят в состав плазмы крови, лимфы. Ионы магния и кальция участвуют в терморегуляции организма. Кальций – основной элемент для образования зубов, костей. Ионы кальция ослабляют действие на организм токсинов. Магний необходим для деятельности нервно-мышечного аппарата, при его недостатке наблюдается мышечное подергивание, остановка роста конечностей.
Например, ионы натрия регулируют содержание воды в организме, передачу нервного импульса. Его недостаток приводит к головной боли, слабости, слабой памяти, потери аппетита, а избыток – к повышению артериального давления, заболеваниям сердца. Рекомендуется потреблять в день не более 5г поваренной соли на взрослого человека.
Mg - осветительные ракеты
Al - в зажигательных бомбах и не только: алюминиевая фольга, которая способна вызывать помехи на вражеских радиолокационных станциях, сбрасывалась самолетами
Ti - для танковой брони.
Сернокислый барий задерживает рентгеновские лучи значительно лучше, чем мягкие ткани человеческого организма. Этим свойством медики пользуются для диагностики желудочных заболеваний. Больному дают на завтрак «бариевую кашу»-смесь сульфата бария с манной кашей (или водой) — и затем просвечивают рентгеновскими лучами: непрозрачная для них «бариевая каша» позволяет врачу получить точное представление о состоянии желудочно-кишечного тракта и определить место заболевания. Благодаря способности поглощать рентгеновские лучи и гамма-лучи барит служит надежным защитным материалом в рентгеновских установках и ядерных реакторах.
ДОМАШНЕЕ ЗАДАНИЕ : читать параграф ,выполнить задание , подготовить сообщение о металлах побочных подгрупп
ПРИЛОЖЕНИЕ
| История открытия алюминия |
| Соединения алюминия были известны человеку с древних времён. Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO4)2. Они находили широкое применение. Они использовались в качестве протравы и как средство, останавливающее кровь. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Известен интересный исторический факт, как Архелай- полководец из Рима во время войны с персами приказал намазать башни, которые служили в качестве оборонительных сооружений, квасцами. Персам так и не удалось сжечь их.
Еще одним из соединений алюминия были природные глины, в состав которых входит оксид алюминия Al2O3.
Первые попытки получить алюминий только в середине XIX века. Попытка предпринятая датским учёным Х.К.Эрстедом увенчалась успехом. Для получения он использовал амальгированный калий в качестве восстановителя алюминия из оксида. Но что за металл был получен тогда выяснить так и не удалось. Через некоторое время, через два года, алюминий был получен немецким ученым-химиком Велером, который получил алюминий, используя нагревание безводного хлорида алюминия с металлическим калием.
Многие годы труда немецкого ученого не прошли даром. За 20 лет он сумел приготовить гранулированный металл. Он оказался похожим на серебро, но был значительно легче его. Алюминий был очень дорогим металлом, и вплоть до начала XX века, его стоимость была выше стоимости золота. Поэтому многие-многие годы алюминий использовался как музейный экспонат. |
| История открытия кальция |
| С соединениями кальция человек знаком очень давно. С древних времен ему были известны алебастр, гипс, известняк, мел, мрамор. Еще в давние времена человек обжигая известняк, получал негашеную известь. Об этом процессе упоминал Плиний Старший. В 1755 году химик Дж. Блэк, изучая процесс обжига выявил, что потеря массы известняка при обжиге происходит за счет выделения углекислого газа.Многим из вас знаком алебастр, который широко используется в строительстве. Этим словом называли два вещества-минерала. Первым было вещество-сульфат кальция. В Египте алебастром называли карбонат кальция (кальцит).
Гипс -как строительный материал использовался, опять же, с древних времен. Данный минерал использовался при строительстве культовых помещений, пирамид. Под словом гипс понимали так же два минерала. Одним был-сам гипс, а вторым продукт, полученный при частичной гидратации (удаление воды).
Чистый оксид кальция впервые описан немецким ученым-химиком И. Потт. Это произошло в 1746 году.
А вот попытки получить металл кальций из оксида длительное время не удавалось. Впервые это сделал Г.Дэви. |
История открытия бария
История этого элемента уходит истоками в далекое средневековье, когда в Европе повсюду бушевали алхимические страсти, разжигаемые идеей получения золота из «недефицитных» материалов.
В 1602 году болонский сапожник и по совместительству алхимик Касциароло подобрал в окрестных горах камень, который оказался настолько тяжелым, что не заподозрить в нем присутствие золота мог только полный профан. Но Касциароло был не таков. Перед ним засияли радужные перспективы, и он, притащив находку в свою сапожно-алхимическую мастерскую, тут же принялся за работу.
Для начала решено было прокалить камень с углем и олифой. И хоть выделить золото при этом почему-то не удалось, опыт принес явно обнадеживающие результаты: охлажденный продукт прокаливания светился в темноте красноватым светом.
Будучи человеком общительным, Касциароло не стал скрывать от своих коллег-алхимиков тайну необычного камня. Это сенсационное сообщение привело золотоискательскую братию в состояние поисковой горячки: найденный минерал, получивший ряд названий — «солнечный камень», «болонский камень», «болонский самоцвет», стал главным участником всевозможных реакций и экспериментов. Но время шло, золото и не думало выделяться, и интерес к новому минералу постепенно пропал.
Лишь спустя полтора столетия, в 1774 году, известные шведские химики Карл Шееле и Юхан Ган подвергли «болонский камень» тщательному исследованию и установили, что в нем содержится особая «тяжелая земля», которую сначала назвали «барот», а затем — «барит» (от греческого слова «барос»-тяжелый). Сам же металл, образующий эту «землю», был наречен барием