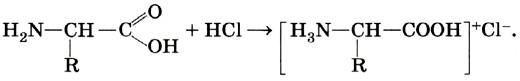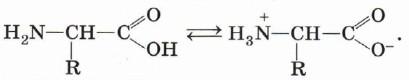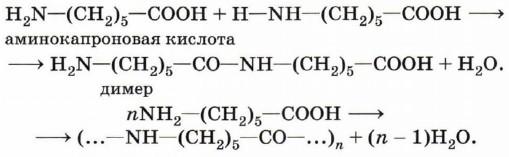10 класс
Урок №28
Тема урока: Аминокислоты.
Цели и задачи урока:
Образовательные: дать понятие об аминокислотах как органических амфотерных соединениях;
- рассмотреть их строение, классификацию, изомерию и номенклатуру;
- изучить основные способы получения и применения аминокислот;
- изучить практическую значимость аминокислот для человека.
Развивающие: расширить сведения о влиянии строения веществ на их свойства,
способствовать формированию умения учащихся находить причинно-следственные связи между явлениями,
развивать у учащихся умение выделять главное, сравнивать, сопоставлять, сообщать информацию о загрязнении окружающей среды аминами, а так же о действии их на организм человека.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: ИКТ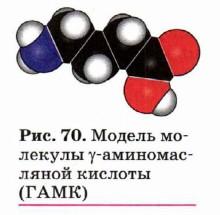
Ход урока:
Организационный момент.
Проверка знаний:
Химические свойства аминов.
упр. 5,7,8 стр. 121
Основная часть.
1. Аминокислоты 
Общую формулу α-аминокислот можно записать так:
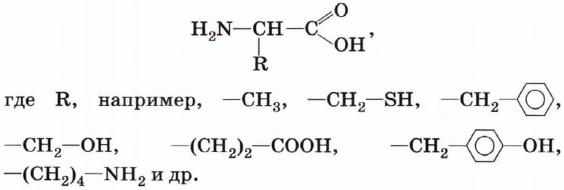
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, их свойства отличаются от характерных свойств карбоновых кислот и аминов.
2. Изомерия и номенклатура
Изомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы, например:

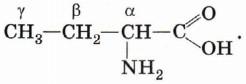
Широко распространены также названия аминокислот, в которых положения аминогруппы обозначаются буквами греческого алфавита: α, β, γ и т. д. Так, 2-аминобутановую кислоту можно назвать также α-аминомасляной кислотой:
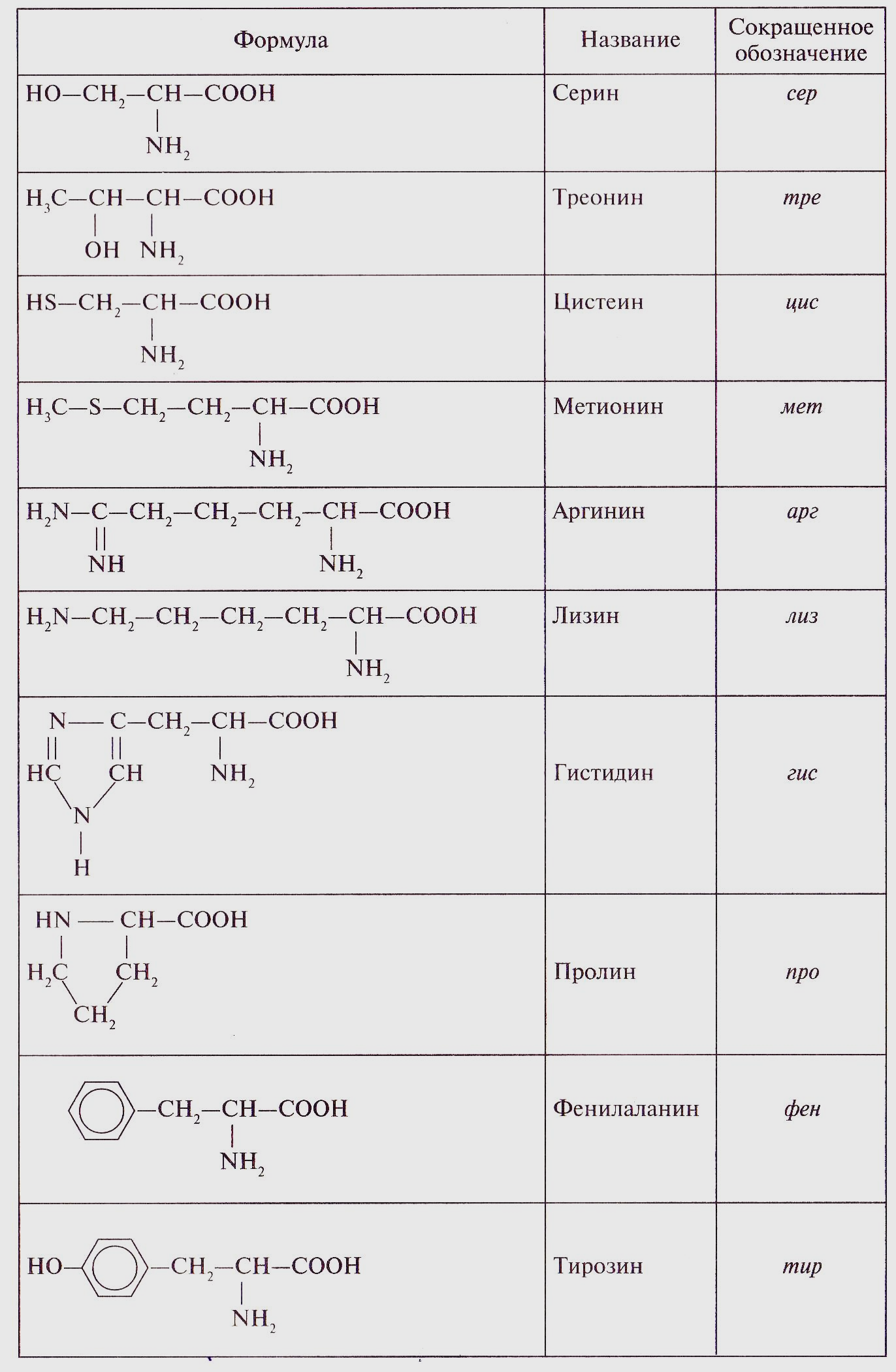
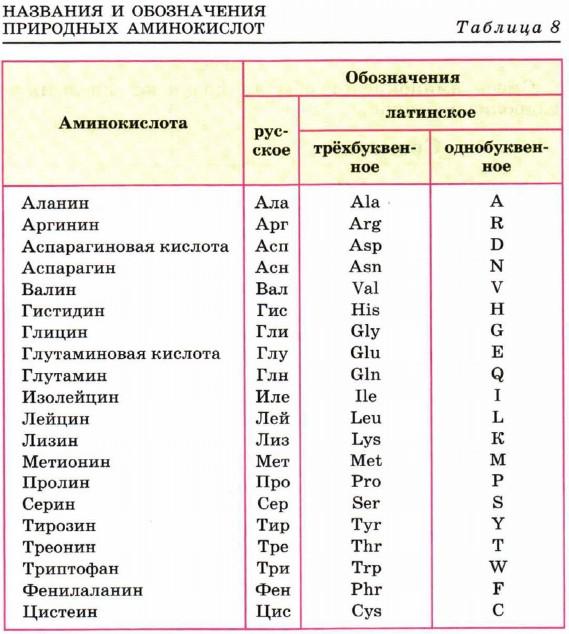
В живых организмах в биосинтезе белка участвуют 20 аминокислот, для которых применяют чаще исторические названия. Эти названия и принятые для них русские и латинские буквенные обозначения приведены в таблице 8.
3. Получение аминокислот
Аминокислоты можно получить из карбоновых кислот, заместив в их радикале атом водорода на галоген, а затем на аминогруппу при взаимодействии с аммиаком, например:
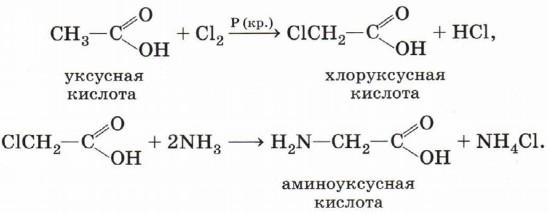
Смесь аминокислот обычно получают кислотным гидролизом белков.
4. Свойства аминокислот
Аминогруппа —NH2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счёт наличия свободной электронной пары у атома азота.
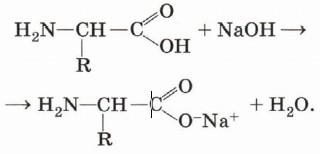
Карбоксильная группа —СООН определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические вещества.
С щелочами они реагируют как кислоты:
С сильными кислотами — как основания-амины:
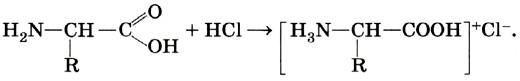
Кроме того, аминогруппа в молекуле аминокислоты вступает во взаимодействие с входящей в её состав карбоксильной группой, образуя внутреннюю соль:
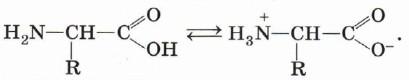
Ионизация молекул аминокислот зависит от характера среды:
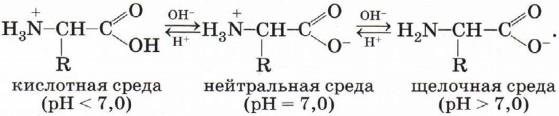
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определённую концентрацию ионов водорода.
Важнейшим свойством аминокислот является способность вступать в реакцию конденсации с выделением воды и образованием амидной группировки —NH—СО—, например:
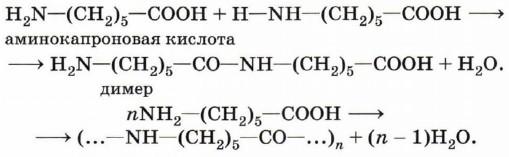
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Продукты конденсации α-аминокислот носят общее название пептиды, а образующаяся между аминокислотными остатками связь —NH—СО— называется пептидной. В зависимости от числа аминокислотных остатков различают простые пептиды (до 10 остатков аминокислот), олигопептиды(до 50 остатков аминокислот) и полипептиды (более 50 остатков аминокислот).
Полипептиды называют также белками или протеинами.
Полиамиды α-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают ди-, три-, ..., полипептиды. В таких соединениях группы —NH—СО— называют пептидными.
5. Физические свойства аминокислот
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от состава радикала R— они могут быть сладкими, горькими или безвкусными.
У всех α-аминокислот, кроме глицина, α-углеродный атом имеет четыре различных заместителя, т. е. является асимметрическим. Следовательно, для каждой аминокислоты возможно существование двух оптических изомеров. Удивительно, что в природе встречаются (и входят в состав белков) только L-аминокислоты, имеющие такое же взаимное расположение заместителей и функциональных групп при асимметрическом центре, как у L-глицеринового альдегида. Строение оптических изомеров удобно изображать с помощью проекционных формул Фишера, знакомых вам по теме «Углеводы».

Различают D-аминокислоты и L-аминокислоты. Расположение аминогруппы NH2 в проекционной формуле слева соответствует L-конфигурации, а справа — D-конфигурации. Знак вращения не связан с принадлежностью соединения к L- или D-ряду. Так, L-серин имеет знак вращения «-», а L-аланин — « + ».
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы.
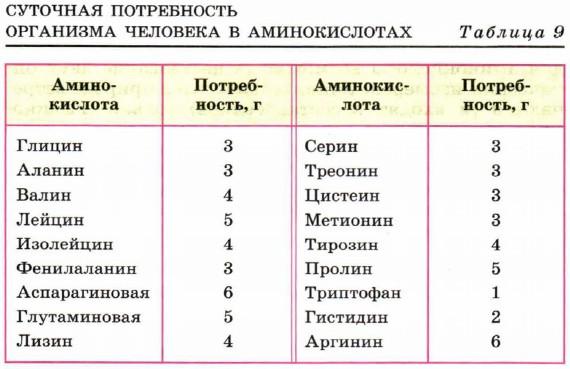
Примерно половина из этих аминокислот относится к незаменимым, так как они не синтезируются в организме человека. Незаменимыми являются такие аминокислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей (табл. 9). Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Например, при фенил кетонурии не синтезируется тирозин.
Неверно было бы полагать, что физиологические функции выполняют только α-аминокислоты. Функционирование нервной системы, например, связано с участием γ-аминомасляной кислоты (ГАМК).
Д/з § 17 до стр. 127 (до белков), упр. 1-7 стр.232
Упражнения по теме: «Аминокислоты»



Упражнения по теме: «Аминокислоты»



| 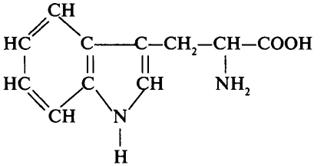 | Триптофан | три |