Просмотр содержимого документа
«Урок по теме: Алкены»



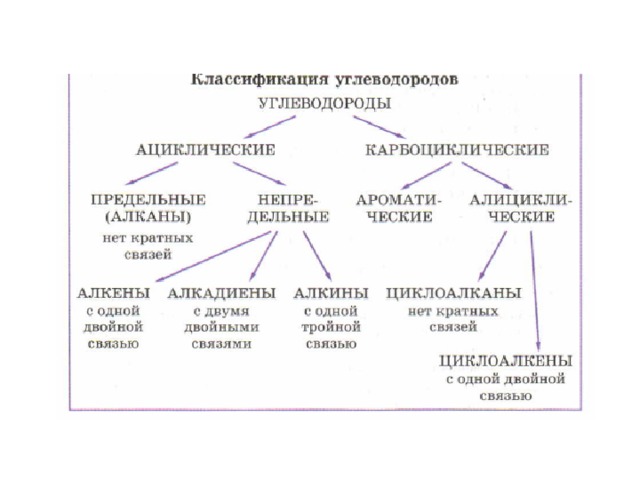

НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. АЛКЕНЫ: строение молекул, гомология и изомерия
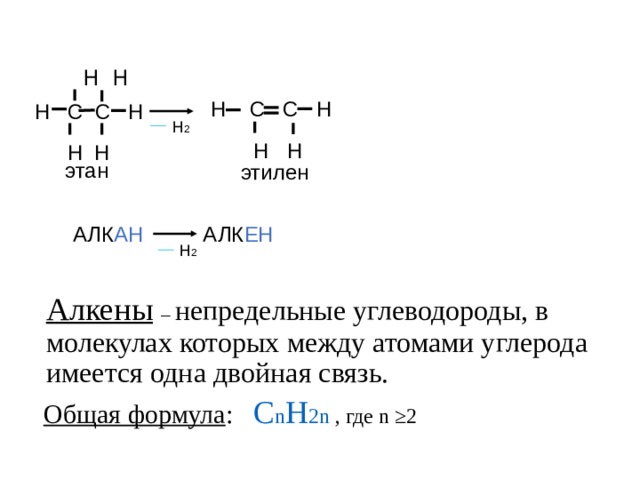
Н Н
Н С С Н
Н С С Н
Н 2
Н Н
Н Н
этан
этилен
АЛК АН АЛК ЕН
Н 2
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная связь.
Общая формула : С n H 2n , где n ≥2
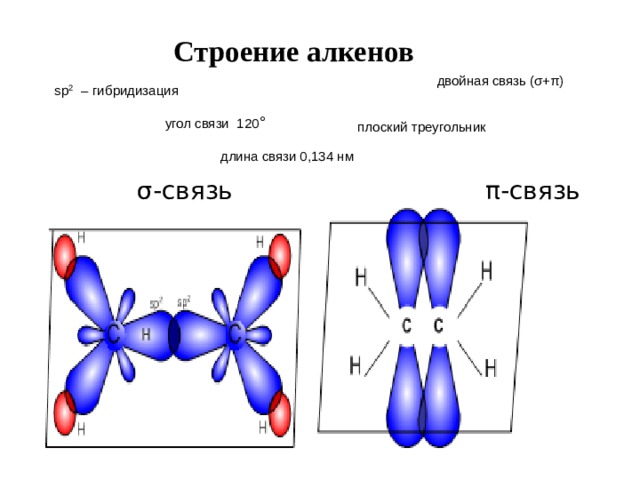
Строение алкенов
двойная связь (σ+π)
sp 2 – гибридизация
угол связи 120 °
плоский треугольник
длина связи 0,134 нм
σ-связь π -связь

Гомологический ряд алкенов:
С 2 Н 2 n
- Эт ен
- Проп ен
- Бут ен
- Пент ен
- Гекс ен
- Гепт ен
- С2Н4
- С3Н6
- С4Н8
- С5Н10
- С6Н12
- С7Н14

Номенклатура алкенов
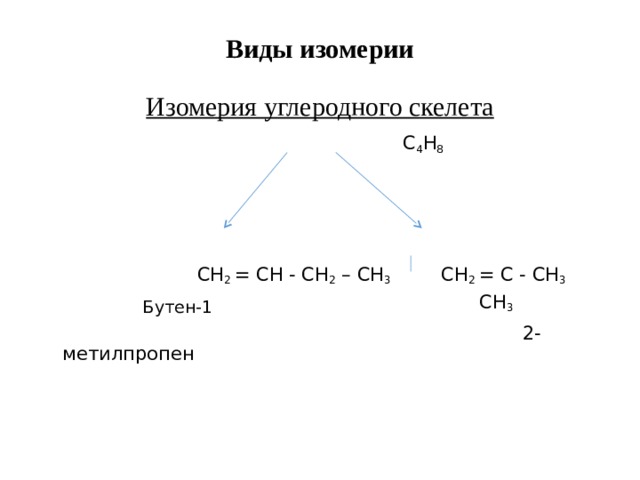
Виды изомерии Изомерия углеродного скелета
С 4 Н 8
СН 2 = СН - СН 2 – СН 3 С H 2 = C - CH 3
Бутен-1 CH 3
2-метилпропен
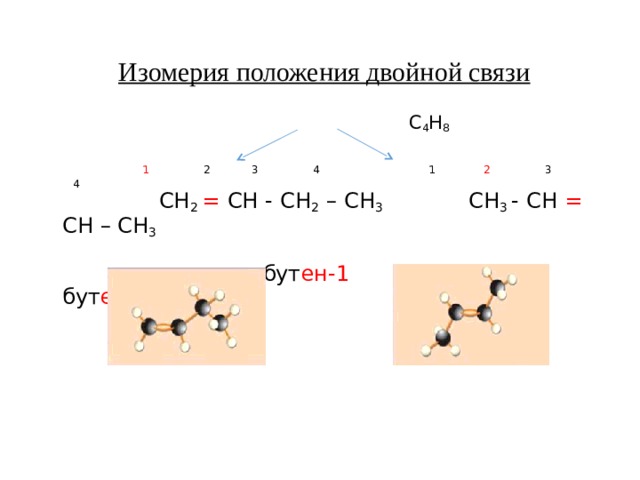
Изомерия положения двойной связи
С 4 Н 8
1 2 3 4 1 2 3 4
СН 2 = СН - СН 2 – СН 3 СН 3 - СН = СН – СН 3
бут ен-1 бут ен-2
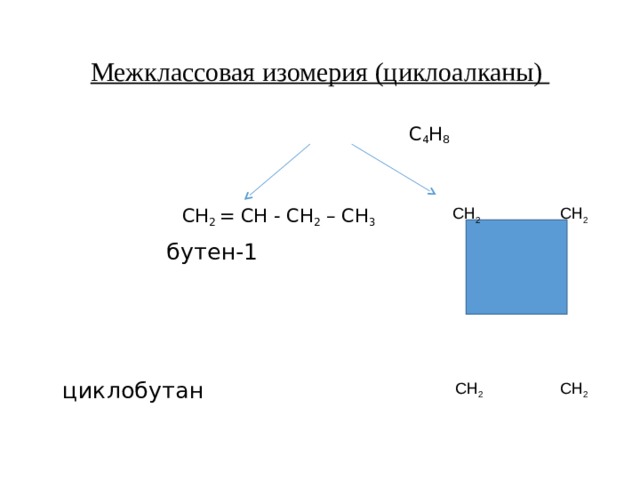
Межклассовая изомерия (циклоалканы)
С 4 Н 8
СН 2 = СН - СН 2 – СН 3
бутен-1
циклобутан
СН 2 СН 2
СН 2 СН 2

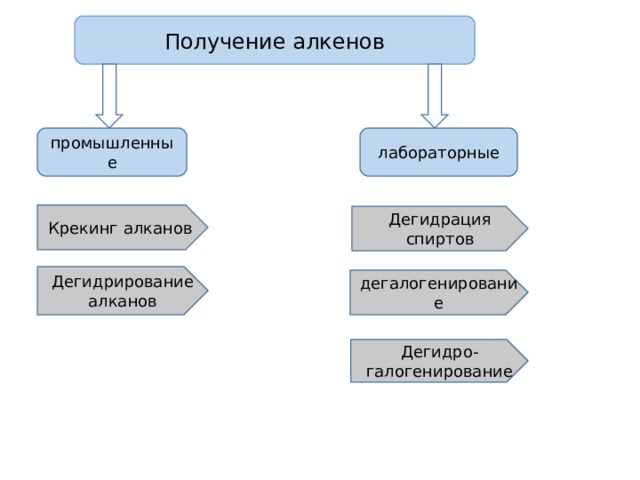
Получение алкенов
промышленные
лабораторные
Крекинг алканов
Дегидрация спиртов
Дегидрирование алканов
дегалогенирование
Дегидро-галогенирование
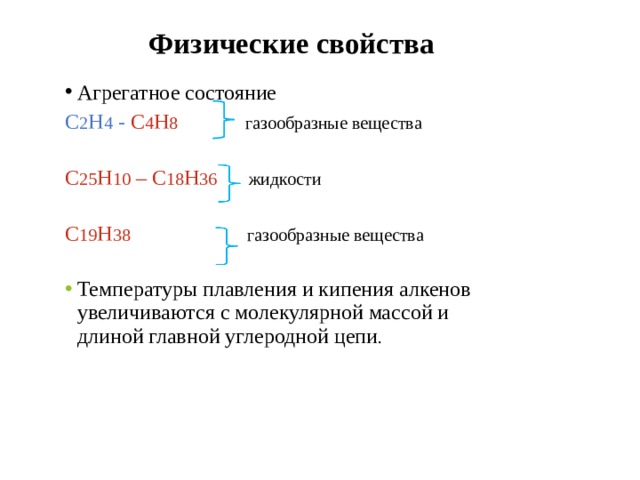
Физические свойства
С 2 Н 4 - С 4 Н 8 газообразные вещества
С 25 Н 10 – С 18 Н 36 жидкости
С 19 Н 38 газообразные вещества
- Температуры плавления и кипения алкенов увеличиваются с молекулярной массой и длиной главной углеродной цепи .
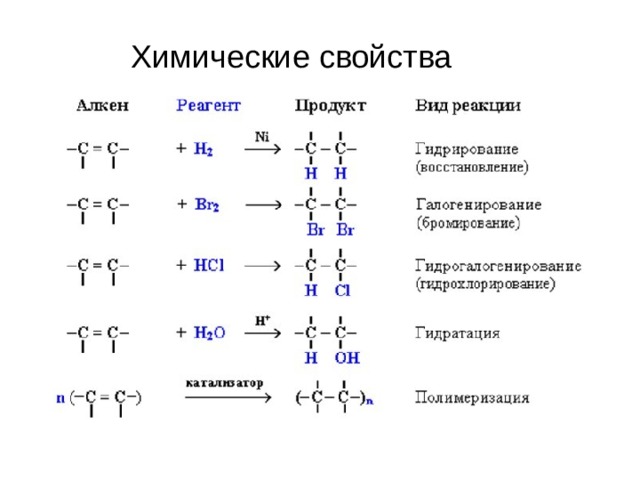
Химические свойства

I. Реакции присоединения:
1.Гидрирование :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.Галогенирование:
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
3.Гидрогалогенирование:
CH2=CH-CH3+НCl → CH3-CHCl-CH3
Правило Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода, а галоген – к менее.
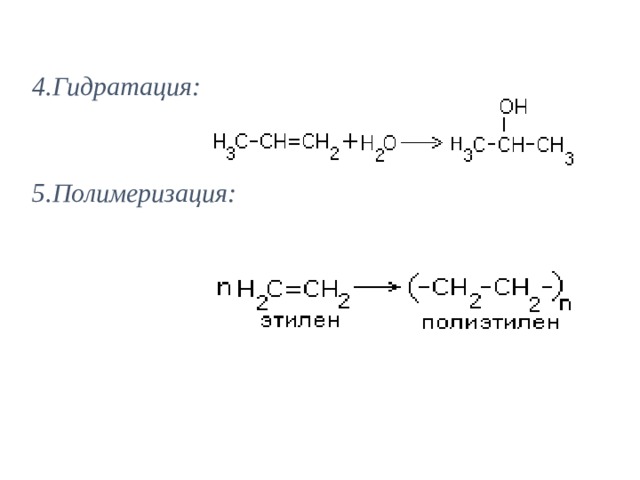
4.Гидратация:
5.Полимеризация:

II. Реакции окисления:
1.Полное окисление (горение):
С2Н4 + 3О2 → 2СО2 + 2Н2О
2.Неполное окисление:
3С2Н4 + 2 KMnO4 +4 Н2О →3HOCH2-CH2OH +
+2MnO2 + 2KOH
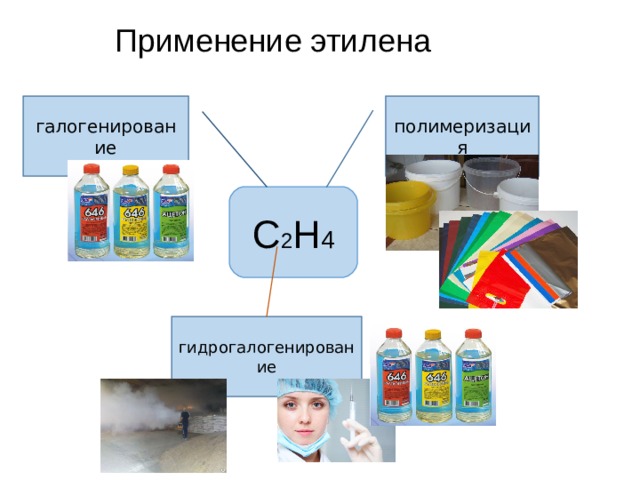
Применение этилена
полимеризация
галогенирование
С 2 Н 4
гидрогалогенирование

Домашнее задание.






































