
Урок-презентация
Химия
8 класс

Основания,
их классификация и свойства в свете теории электролитической диссоциации

ЦЕЛИ УРОКА:
1) сформировать понятие об основаниях как электролитах;
2) рассмотреть классификацию оснований по различным признакам;
3) познакомить практически с химическими свойствами оснований в свете теории электролитической диссоциации;
4) развивать умения и навыки работы с химическими реактивами и химическим оборудованием;
5) учить сравнивать, анализировать, делать выводы;
6) совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций.

ЗАДАЧИ УРОКА:
1) учиться проводить химические реакции и записывать уравнения химических реакций в молекулярной, полной и сокращенной ионной формах;
2) различать свойства растворимых и нерастворимых оснований.

Основания - это сложные вещества, в которых атом металла связан с одной или несколькими гидроксогруппами (ОН).
Названия оснований состоят из двух слов:
гидроксид + название металла в родительном падеже.
Если металл образует соединения с разными степенями окисления, то степень окисления указывается после названия металла в скобках римской цифрой:
Fe(OH) 2 ___ гидроксид железа ( II) .
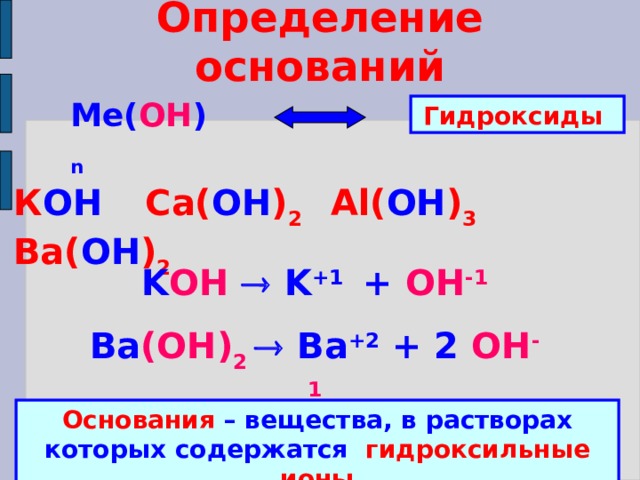
Определение оснований
Ме( ОН ) n
Гидроксиды
К ОН Ca( ОН ) 2 Al( ОН ) 3 Ba( ОН ) 2
K OH K +1 + OH -1
Ba (ОН) 2 Ba +2 + 2 OH -1
Основания – вещества, в растворах которых содержатся гидроксильные ионы
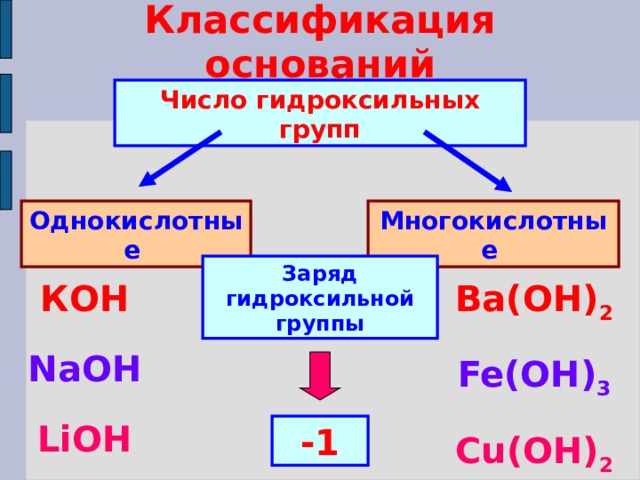
Классификация оснований
Число гидроксильных групп
Однокислотные
Многокислотные
Заряд гидроксильной группы
КОН
NaOH
LiOH
Ba(ОН) 2
Fe(OH) 3
Cu(OH) 2
-1
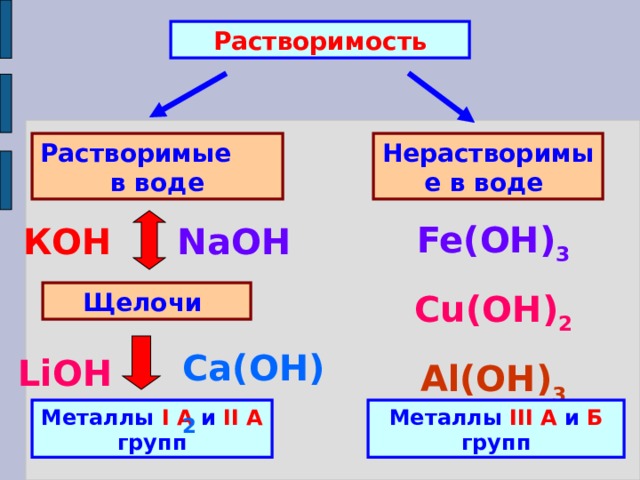
Растворимость
Растворимые в воде
Нерастворимые в воде
Fe(OH) 3
Cu(OH) 2
Al(ОН) 3
КОН
NaOH
Щелочи
Ca(ОН) 2
LiOH
Металлы I А и II А групп
Металлы III А и Б групп

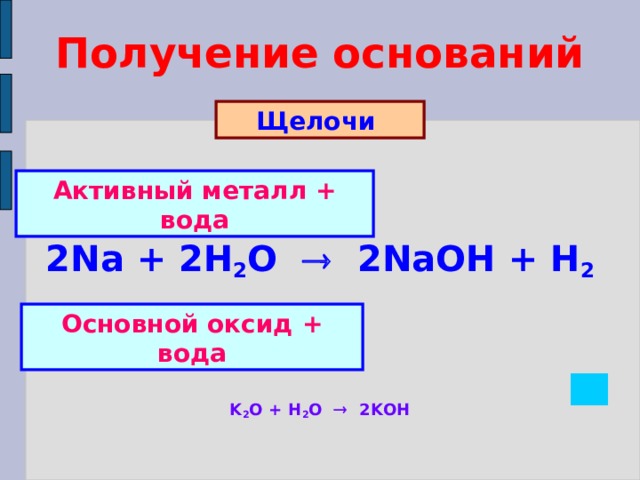
Получение оснований
Щелочи
Активный металл + вода
2Na + 2H 2 O 2NaOH + H 2
Основной оксид + вода
K 2 O + H 2 O 2KOH
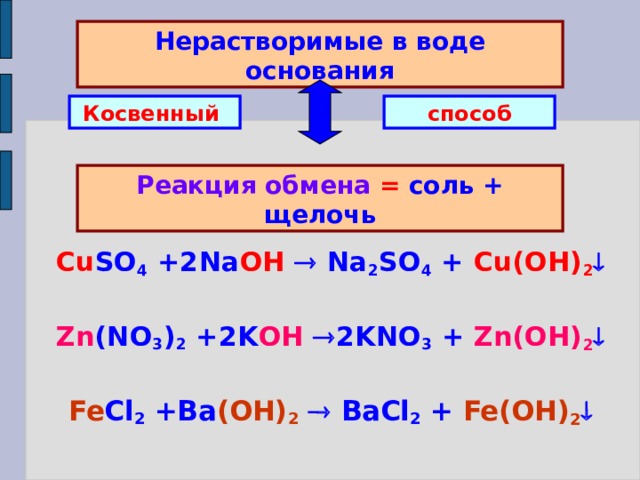
Нерастворимые в воде основания
Косвенный
способ
Реакция обмена = соль + щелочь
Cu SO 4 +2Na OH Na 2 SO 4 + Cu(OH) 2
Zn (NO 3 ) 2 +2K OH 2KNO 3 + Zn(OH) 2
Fe Cl 2 +Ba (OH) 2 BaCl 2 + Fe(OH) 2
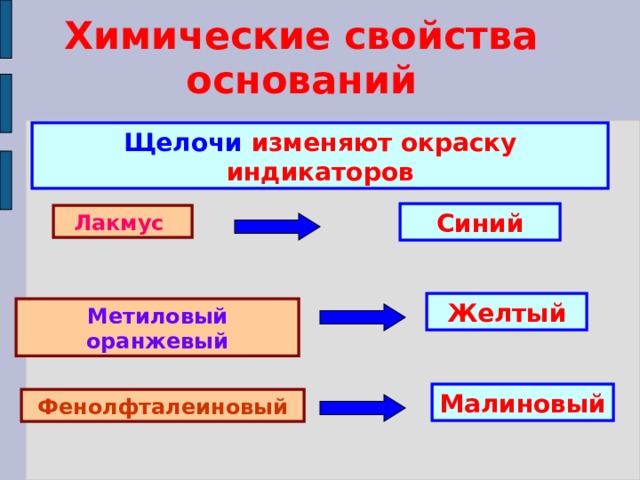
Химические свойства оснований
Щелочи изменяют окраску индикаторов
Синий
Лакмус
Желтый
Метиловый оранжевый
Малиновый
Фенолфталеиновый
 7 " width="640"
7 " width="640"
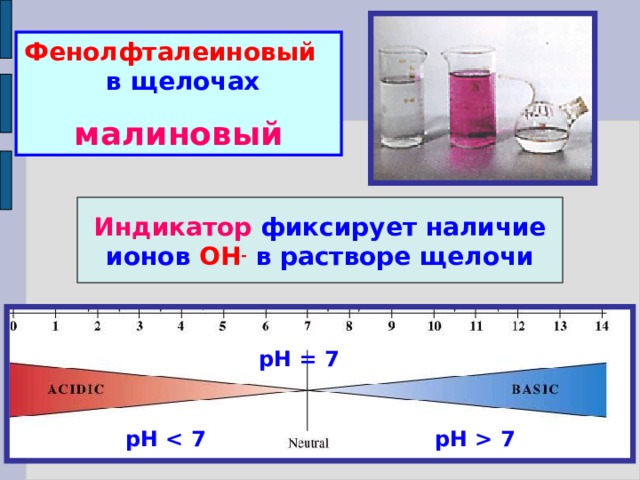
Фенолфталеиновый в щелочах
малиновый
Индикатор фиксирует наличие ионов ОН - в растворе щелочи
рН = 7
рН 7
рН 7

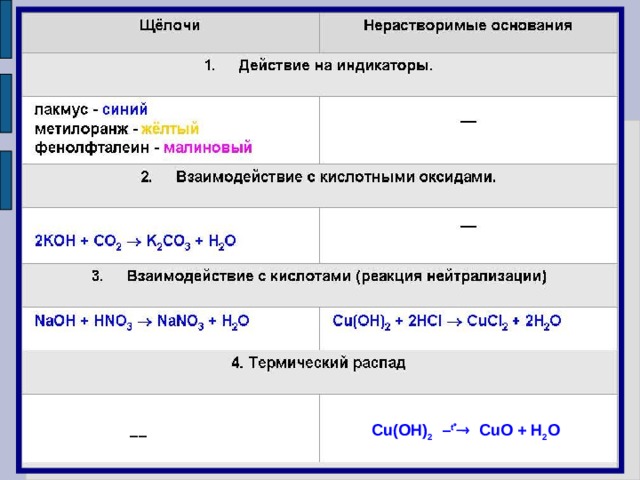
Cu(OH) 2 – t CuO + H 2 O
––

Опыт №1.
Возьмите пробирку. Налейте в нее 1 мл раствора гидроксида натрия.
Добавьте в нее 1 каплю фенолфталеина. Что наблюдаете? Затем в нее
прилейте 2 мл соляной кислоты. Что наблюдаете? Запишите уравнение
реакции в молекулярной, полной и сокращенной ионной форме.
Опыт №2.
В чистую пробирку налейте 1 мл гидроксида натрия. Прилейте в нее 2
Опыт №3.
В пробирку наливаем 1-2 мл раствора гидроксида калиция. Через
Опыт №4.
Полученные в опыте №2 осадок Cu(OH)2 разделить на две части.
Опыт №5.
Вторую часть осадко Cu(OH)2 поместите в ручной зажим и нагрейте над спиртовкой. Что наблюдаете?
По мере выполнения работы учащиеся выносят на доску уравнения реакций.
В чистую пробирку налейте 1 мл гидроксида натрия. Прилейте в нее 2
В пробирку наливаем 1-2 мл раствора гидроксида калиция. Через
Опыт №4.
Полученные в опыте №2 осадок Cu(OH)2 разделить на две части.
Вторую часть осадко Cu(OH)2 поместите в ручной зажим и нагрейте над спиртовкой. Что наблюдаете?
По мере выполнения работы учащиеся выносят на доску уравнения реакций.

Рефлексия – тест
1 вариант 2 вариант
1. Данны вещества: CaO, AI(OH)3, HCI, KOH, Na2SO4, MgO, BA(OH)2, H2SO4, N2O5, NaOH, HNO3, Ca(OH)2, MgCO3, Fe(OH)3.
Выбрать щелочи. Выбрать нерастворимые основания.
2. Выбрать оксиды, с которыми реагирует
NaOH KOH
a) SO2; CO2 а) Na2O; CaO
б) AI2O3; MgO б) CO2; N2O5
в) N2O5; P2O5 в) FeO; K2O
г) CaO; Fe2O3 г) P2O5; SO3
3.Выбрать вещество с которыми реагирует
AI(OH)3 Fe(OH)3
а) CO2 а) H3PO4
б)NaOH б)Na2O
в)H2SO4 в)KOH
4. В растворах щелочей:
Фенолфталеин Лакмус
а)бесцветный; б)синий; в) малиновый; г) красный
5. Соотнесите:
Формула оксида: Формула гидроксида:
1. Fe2o3; 2. CO2; 3.Ca O; 4. P2O5; 1.KOH; 2. H2SO4;3. Fe (OH)2
Формула гидроксида: Формула о ксида:
А.H2CO3 ;Б.Fe(OH)3;В.Fe(OH)2;Г.Ca(OH)2; А.FeO;Б.SO3; В.K2O; Г.Fe2O3
Д. H3PO4 Д.Al2O3

















 7 " width="640"
7 " width="640"














