
Подгруппа хрома

В 1797 французский химик Л. Н. Воклен открыл в сибирской
красной свинцовой руде новый элемент хром и в 1798 году
получил его в свободном состоянии.
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO 4 .
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Хром является довольно распространённым элементом (0,02 масс. долей, %). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Плотность 7,19 г/см 3 ;
t плавления 1890°С;
t кипения 2480°С.
В свободном виде — голубовато- белый металл.
Хром (с примесями) является одним из самых твердых металлов.
Очень чистый хром достаточно хорошо поддаётся механической обработке, пластичен.
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома (III) Cr2O3.
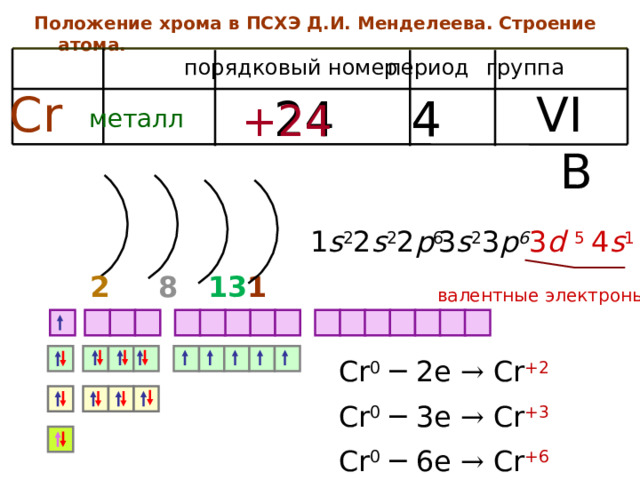
Положение хрома в ПСХЭ Д.И. Менделеева. Строение атома.
период
группа
порядковый номер
Cr
VI B
4
4
24
+24
металл
2 s 2 2 p 6
4 s 1
3 d 5
1 s 2
3 s 2 3 p 6
1
13
2
8
валентные электроны
Cr 0 ─ 2e → Cr +2
Cr 0 ─ 3e → Cr +3
Cr 0 ─ 6e → Cr +6

Получение
Из хромистого железняка Fe(CrO 2 ) 2 (хромита железа) получают феррохром восстановлением в электропечах коксом (углеродом):
FeO· Cr 2 O 3 + 4C → Fe + 2 Cr + 4CO↑
Феррохром — сплав железа и хрома (около 60% ),
основные примеси – углерод (до5%) кремний (до 8%), сера (до 0,05 %),
фосфор (до 0,05 %).
Феррохром применяют для производства легированных
сталей.

Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO 2 ) 2 + 8Na 2 CO 3 + 7O 2 → 8Na 2 CrO 4 + 2Fe 2 O 3 + 8CO 2 ↑
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата углём:
Na 2 Cr 2 O 7 + 2C → Cr 2 O 3 + Na 2 CO 3 + CO↑
5) с помощью алюминотермии получают металлический хром:
Cr 2 O 3 + 2Al → Al 2 O 3 + 2 Cr + 130 ккал

С помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
1) восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
2) разряд ионов водорода с выделением газообразного водорода;
3) разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома;
Cr 2 O 7 2− + 14Н + + 12е − = 2 Cr + 7H 2 O
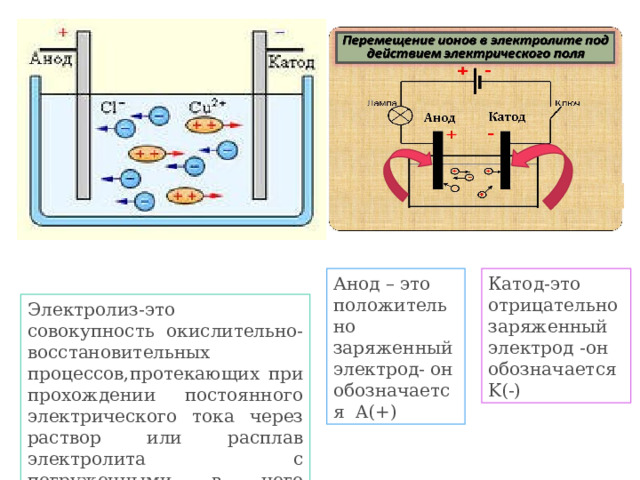
Катод-это отрицательно заряженный электрод -он обозначается K(-)
Анод – это положительно заряженный электрод- он обозначается A(+)
Электролиз-это совокупность окислительно-восстановительных процессов,протекающих при прохождении постоянного электрического тока через раствор или расплав электролита с погруженными в него электродами.
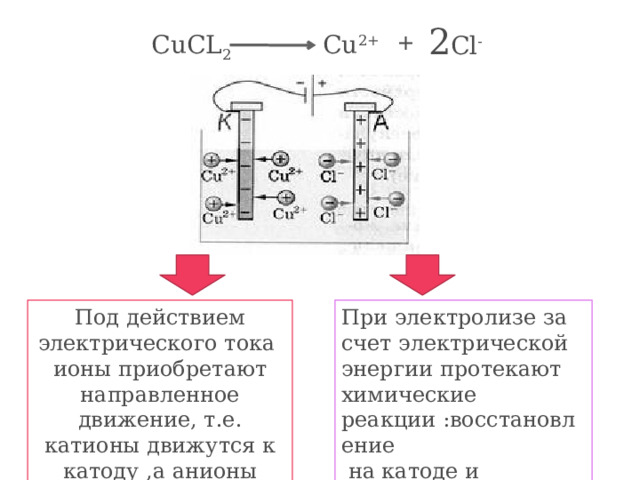
2 Cl -
CuCL 2
Cu 2+
+
Под действием электрического тока ионы приобретают направленное движение, т.е. катионы движутся к катоду ,а анионы движутся к аноду
При электролизе за счет электрической энергии протекают химические реакции :восстановление
на катоде и окисление на аноде

I. В расплаве электролита присутствуют только ионы, образовавшиеся при его
диссоциации, они и участвуют в окислительно-восстановительном процессе
Электролиз расплава NaOH
Электролиз расплава NaBr
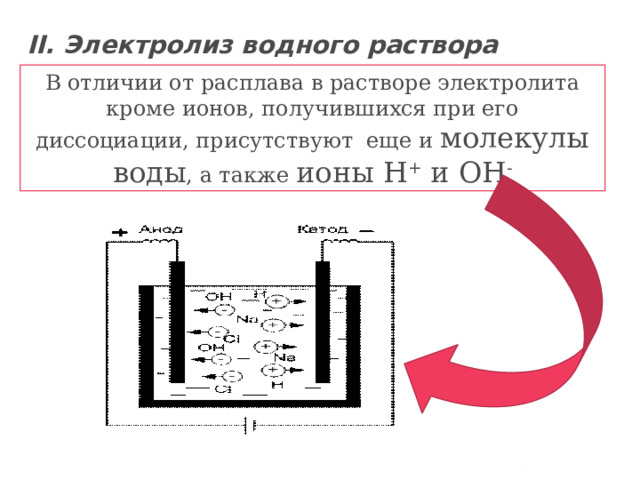
II. Электролиз водного раствора электролита
В отличии от расплава в растворе электролита кроме ионов, получившихся при его диссоциации, присутствуют еще и молекулы
воды , а также ионы H + и OH -

LiKBaCaNaMg
MnZnCrFeCoNiSnPb
H 2
CuAgHgAu
Al
- Если у катода накапливаются катионы металла (стоящего в ряду напряжений после H2), то восстанавливаются ионы металла
Cu 2+ +2e - =Cu 0
2) Если у катода накапливаются катионы металла,стоящего в начале ряда напряжений
(по AL), то восстанавливаются ионы водорода из молекул воды вместо катиона данного металла
2 H2O + 2e - = H2 + 2 OH -

LiKBaCaNaMgAl
MnZnCrFeCoNiSnPb
H 2
CuAgHgAu
3) Если у катода накапливаются катионы металла,который расположен в ряду напряжений (после AL и до H2),то будут протекать два процесса: восстановление иона металла и ионов водорода из молекул воды
Zn 2+ +2e - =Zn 0
2 H2O +2e - =H2 + 2 OH -
4) Если в растворе смесь катионов разных металлов, то сначала восстанавливается менее активный
5) При электролизе раствора кислоты на катоде восстанавливаются катионы водорода
2 H + +2e - =H2 0

Последовательность разрядки анионов на аноде зависит от природы аниона:
F - , NO3 - , SO4 2- , OH - , CL - , S 2- , Br - , I -
Восстановительная активность анионов усиливается
1) При электролизе растворов солей бескислородных кислот( кроме фторидов)
окисляются анионы кислотных остатков
2 CL - - 2e - =CL 2
2) При электролизе растворов солей кислородосодержащих кислот и фторидов идет процесс окисления гидроксид-ионов из молекул воды
2 H2O – 4e - =O2 + 4 H +
3) При электролизе растворов щелочей окисляются гидроксид-ионы
4OH - -4e - =O2 +2H2O
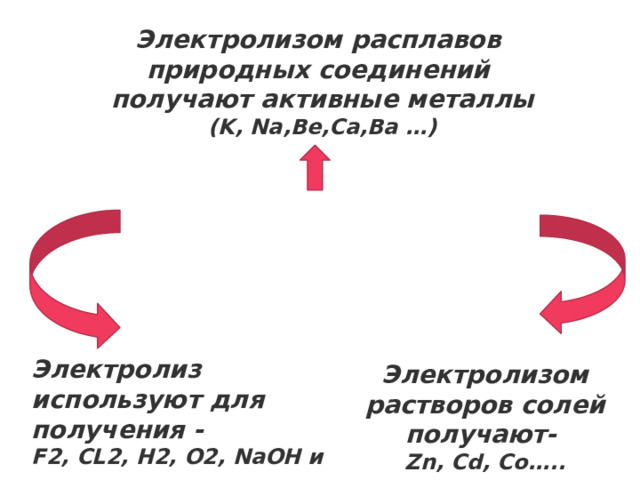
Электролизом расплавов природных соединений получают активные металлы
(K, Na,Be,Ca,Ba …)
Применение электролиза
Электролиз используют для получения -
F2, CL2, H2, O2, NaOH и ….
Электролизом растворов солей получают-
Zn, Cd, Co…..
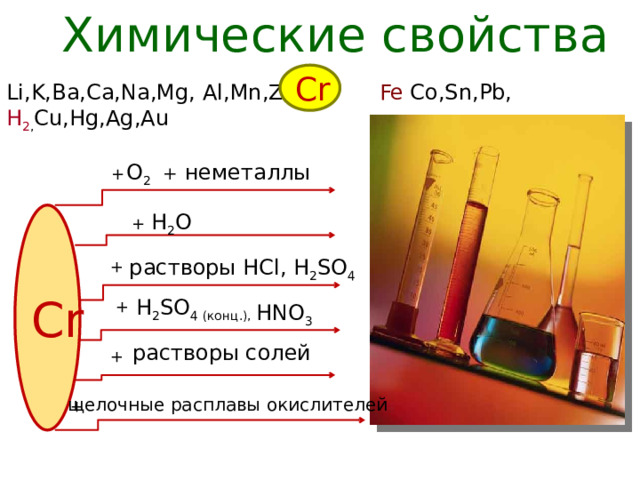
Химические свойства
Cr
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H 2 , Cu,Hg,Ag,Au
+ неметаллы
О 2
+
Cr
H 2 O
+
растворы HCl, H 2 SO 4
+
H 2 SO 4 (конц.),
HNO 3
+
растворы солей
+
щелочные расплавы окислителей
+

При комнатной температуре хром химически мало активен
из-за образования на его поверхности тонкой прочной
оксидной пленки.
При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами, например :
кислородом, галогенами, азотом, серой.
Составьте уравнения реакций
хрома с перечисленными неметаллами.
Рассмотрите данные реакции как
окислительно-восстановительные.

4
Cr 0 + O 2 0 = Cr 2 +3 O 3 –2
2
3
Cr 0 – 3e → Cr +3 4
O 2 0 + 4e → 2O –2 3
Cr 0 – восстановитель, процесс окисления
O 2 0 – окислитель, процесс восстановления
2
3
2
Cr 0 + Br 2 0 = Cr +3 Br 3 –1
Cr 0 – 3e → Cr +3 2
Br 2 0 + 2e → 2Br –1 3
Cr 0 – восстановитель, процесс окисления
Br 2 0 – окислитель, процесс восстановления

2
Cr 0 + N 2 0 = Cr +3 N –3
2
Cr 0 – 3e → Cr +3 2
N 2 0 + 6e → 2N –3 1
Cr 0 – восстановитель, процесс окисления
N 2 0 – окислитель, процесс восстановления
Cr 0 + S 0 = Cr 2 +3 S 3 –2
2
3
Cr 0 – 3e → Cr +3 2
S 0 + 2e → S –2 3
Cr 0 – восстановитель, процесс окисления
S 0 – окислитель, процесс восстановления

В раскаленном состоянии хром реагирует с парами воды:
2Cr + 3H 2 O = Cr 2 O 3 + 3H 2
Cr
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn, Fe Co,Sn,Pb, H 2 , Cu,Hg,Ag,Au
В ряду напряжений хром находится левее водорода и поэтому
в отсутствии воздуха может вытеснять водород из растворов
соляной и серной кислот, образуя соли хрома (II).
Составьте уравнения реакций хрома c растворами соляной и серной кислот.
Рассмотрите данные реакции как окислительно-восстановительные.

Cr 0 + H +1 Cl = Cr +2 Cl 2 + H 2 0
2
Cr 0 – 2e → Cr +2 1
2H + + 2e → H 2 0 1
Cr 0 – восстановитель, процесс окисления
HCl (за счет Н +1 ) – окислитель, процесс восстановления
Cr 0 + H 2 +1 SO 4 = Cr +2 SO 4 + H 2 0
Cr 0 – 2e → Cr +2 1
2H + + 2e → H 2 0 1
Cr 0 – восстановитель, процесс окисления
H 2 SO 4 ( за счет Н +1 ) – окислитель,
процесс восстановления
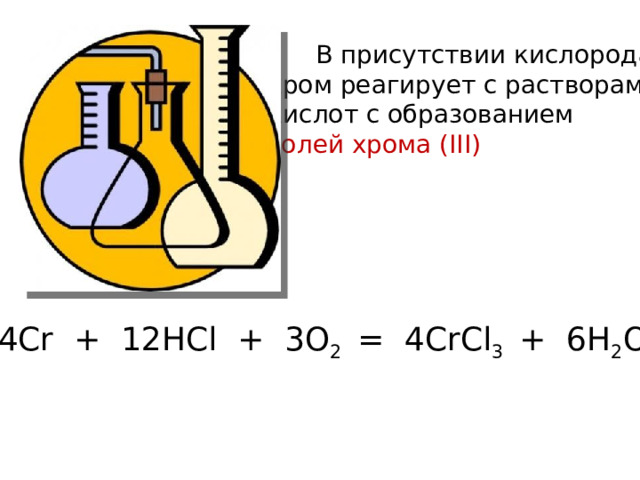
В присутствии кислорода
хром реагирует с растворами
кислот c образованием
солей хрома (III)
4Cr + 12HCl + 3O 2 = 4CrCl 3 + 6H 2 O

Концентрированные серная и азотная
кислоты на холоду пассивируют хром
При сильном нагревании кислоты
pастворяют хром с образованием
cолей хрома (III)
Cr + H 2 SO 4 → Cr 2 (SO 4 ) 3 + SO 2 + H 2 O
Cr + HNO 3 → Cr(NO 3 ) 3 + NO 2 + H 2 O
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.

Cr 0 + H 2 S +6 O 4 → Cr 2 +3 (SO 4 ) 3 + S +4 O 2 + H 2 O
Cr 0 – 3e → Cr +3 2
S +6 + 2e → S +4 3
2Cr + 6H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Cr 0 – восстановитель, процесс окисления
H 2 SO 4 (за счет S +6 ) – окислитель, процесс восстановления
Cr 0 + HN +5 O 3 → Cr +3 (NO 3 ) 3 + N +4 O 2 + H 2 O
Cr 0 – 3e → Cr +3 1
N +5 + 1e → N +4 3
Cr + 6HNO 3 = Cr(NO 3 ) 3 + 3NO 2 + 3H 2 O
Cr 0 – восстановитель, процесс окисления
HNO 3 (за счет N +5 ) – окислитель, процесс восстановления

Хром способен вытеснять многие металлы, например
медь, олово, серебро и другие, из растворов их солей:
Составьте уравнение реакции хрома c раствором сульфата
меди (II). Рассмотрите данную реакцию как окислительно-восстановительную.
Cr 0 + Cu +2 SO 4 → Cr +2 SO 4 + Cu 0
Cr 0 – 2e → Cr +2 1
Cu +2 + 2e → Cu 0 1
Cr + CuSO 4 = CrSO 4 + Cu
Cr 0 – восстановитель, процесс окисления
CuSO 4 (за счет Cu +2 ) – окислитель, процесс
восстановления

Растворы щелочей на хром практически не действуют.
Хром реагирует с щелочными расплавами окислителей.
В качестве окислителей используют нитраты натрия, калия,
хлорат калия и другие окислители.
При взаимодействии с щелочными расплавами окислителей
хром образует соли анионного типа, в которых проявляет
высшую степень окисления.
сплавление
Cr + KClO 3 + KOH K 2 CrO 4 + KCl + H 2 O
Рассмотрите эту реакцию как окислительно-восстановительную
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
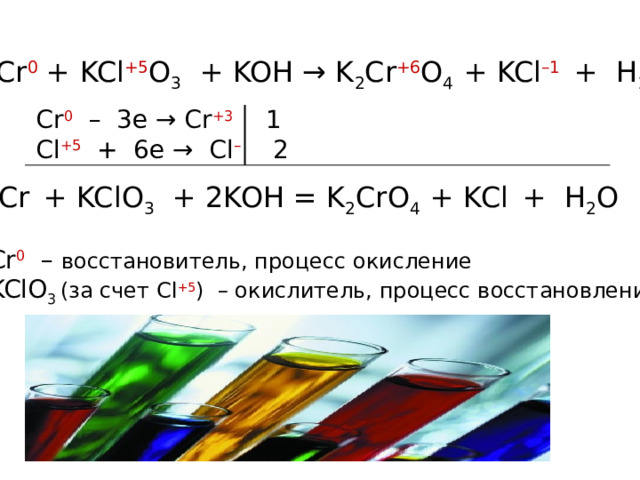
Cr 0 + KCl +5 O 3 + KOH → K 2 Cr +6 O 4 + KCl –1 + H 2 O
Cr 0 – 3e → Cr +3 1
Cl +5 + 6e → Cl – 2
Cr + KClO 3 + 2KOH = K 2 CrO 4 + KCl + H 2 O
Cr 0 – восстановитель, процесс окисление
KClO 3 (за счет Cl +5 ) – окислитель, процесс восстановление

Хром - постоянная составная часть растительных и животных организмов. В крови содержится от 0,012 до 0,0035 % хрома.
Хром имеет большое значение в метаболизме углеводов и жиров, а также участвует в процессе синтеза инсулина. Важнейшая его биологическая роль состоит в регуляции углеводного обмена и уровня глюкозы в крови
Элемент способствует нормальному формированию и росту детского организма. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Хром важный компонент во многих легированных сталях.
Хром применяется для производства сплавов:
Используется в качестве износоустойчивых и красивых
хром-30 и хром-90, незаменимых для производства сопел
гальванических покрытий (хромирование)
мощных плазмотронов и в авиакосмической промышленности.

Соединения хрома
Соединения хрома (II)
оксид
гидроксид
соли
Соединения хрома (III)
оксид
гидроксид
соли
Соединения хрома (VI)
соли
гидроксид
оксид

Соединения хрома (II)
CrO
Оксид хрома (II) – кристаллы черного цвета,
имеет основный характер
При осторожном нагревании
гидроксида хрома (II) в отсутствии кислорода получают оксид хрома (II). Составьте уравнение реакции.
Cr(OH) 2 = CrO + H 2 O
При более высоких температурах оксид хрома (II)
диспропорционирует:
700°
3CrO = Cr + Cr 2 O 3

Составьте уравнение реакции оксида хрома (II) с соляной и
серной кислотами. Рассмотрите реакции с точки зрения ТЕД.
CrO + 2HCl = CrCl 2 + H 2 O
CrO + 2H + + Cl – = Cr 2+ + 2Cl – + H 2 O
CrO + 2H + = Cr 2+ + H 2 O
CrO + H 2 SO 4 = CrSO 4 + H 2 O
CrO + 2H + + SO 4 2– = Cr 2+ + SO 4 2– + H 2 O
CrO + 2H + = Cr 2+ + H 2 O
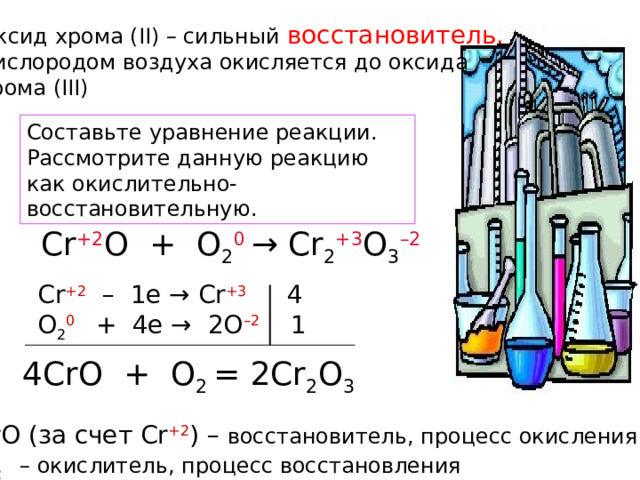
Оксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до оксида
хрома (III)
Составьте уравнение реакции.
Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr +2 O + O 2 0 → Cr 2 +3 O 3 –2
Cr +2 – 1e → Cr +3 4
O 2 0 + 4e → 2O –2 1
4CrO + O 2 = 2Cr 2 O 3
CrO (за счет Cr +2 ) – восстановитель, процесс окисления
O 2 – окислитель, процесс восстановления

Гидроксид хрома (II)
Cr(OH) 2
Гидроксид хрома (II) получают в виде желтого осадка действием растворов щелочей на соли хрома (II) без доступа воздуха .
Составьте уравнение реакции получения гидроксида хрома (II) действием гидроксида натрия на хлорид хрома (II). Рассмотрите реакцию с точки зрения ТЕД.
CrCl 2 + 2NaOH = Cr(OH) 2 ↓ + 2NaCl
Cr 2+ + 2Cl – + 2Na + + 2OH – = Cr(OH) 2 ↓ + 2Na + + 2Cl –
Cr 2+ + 2OH – = Cr(OH) 2 ↓
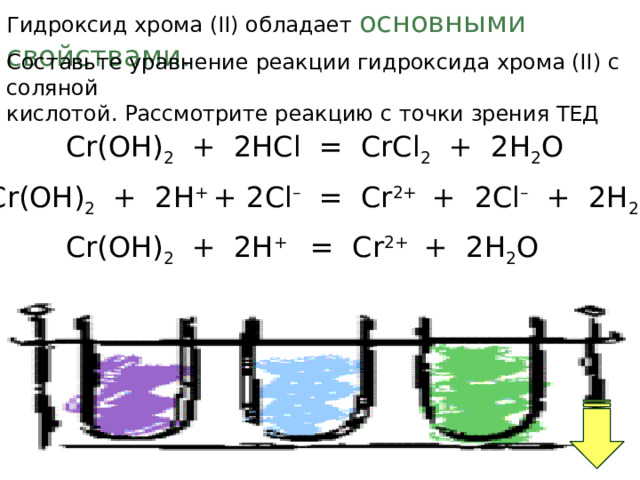
Гидроксид хрома (II) обладает основными свойствами.
Составьте уравнение реакции гидроксида хрома (II) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД
Cr(OН) 2 + 2HCl = CrCl 2 + 2H 2 O
Cr(OН) 2 + 2H + + 2Cl – = Cr 2+ + 2Cl – + 2H 2 O
Cr(OН) 2 + 2H + = Cr 2+ + 2H 2 O

Гидроксид хрома (II) – сильный восстановитель.
Кислородом воздуха окисляется до гидроксида хрома (III)
Составьте уравнение реакции. Рассмотрите данную реакцию
как окислительно-восстановительную.
Cr +2 (ОН) 2 + O 2 0 + Н 2 О → Cr +3 (O –2 Н) 3
Cr +2 – 1e → Cr +3 4
O 2 0 + 4e → 2O –2 1
4Cr(OН) 2 + O 2 + 2Н 2 О = 4Cr(OН) 3
Cr(OН) 2 (за счет Cr +2 ) – восстановитель, процесс окисления
O 2 – окислитель, процесс восстановления

Соли хрома (II)
Водные растворы солей хрома (II) получают без доступа
воздуха растворением металлического хрома в разбавленных
кислотах в атмосфере водорода или восстановлением цинком
в кислой среде солей трехвалентного хрома.
Безводные соли хрома (II) белого цвета, а водные растворы и
кристаллогидраты — синего цвета .
Соединения хрома (II) – сильные восстановители . Легко окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома .
Реагируют с концентрированными серной и азотной кислотами:
CrCl 2 + O 2 + HCl → CrCl 3 + H 2 O
CrCl 2 + H 2 SO 4 → Cr 2 (SO 4 ) 3 + SO 2 ↑ + HCl ↑ + H 2 O
CrCl 2 + HNO 3 → Cr(NO 3 ) 3 + NO 2 ↑ + HCl ↑ + H 2 O
Рассмотрите эти реакции как окислительно-
восстановительные. Расставьте коэффициенты. .
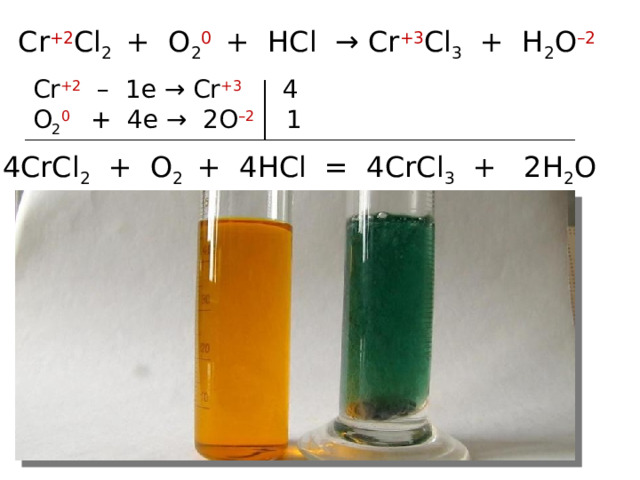
Cr +2 Cl 2 + O 2 0 + HCl → Cr +3 Cl 3 + H 2 O –2
Cr +2 – 1e → Cr +3 4
O 2 0 + 4e → 2O –2 1
4CrCl 2 + O 2 + 4HCl = 4CrCl 3 + 2H 2 O
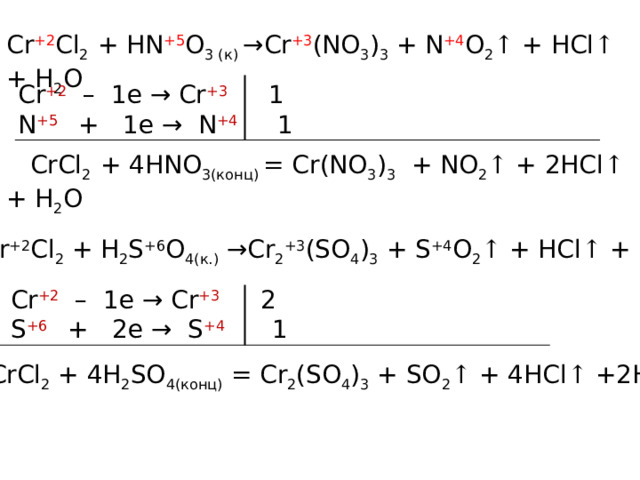
Cr +2 Cl 2 + HN +5 O 3 (к) →Cr +3 (NO 3 ) 3 + N +4 O 2 ↑ + HCl ↑ + H 2 O
Cr +2 – 1e → Cr +3 1
N +5 + 1e → N +4 1
CrCl 2 + 4HNO 3(конц) = Cr(NO 3 ) 3 + NO 2 ↑ + 2HCl ↑ + H 2 O
Cr +2 Cl 2 + H 2 S +6 O 4(к.) →Cr 2 +3 (SO 4 ) 3 + S +4 O 2 ↑ + HCl ↑ + H 2 O
Cr +2 – 1e → Cr +3 2
S +6 + 2e → S +4 1
2CrCl 2 + 4H 2 SO 4(конц) = Cr 2 (SO 4 ) 3 + SO 2 ↑ + 4HCl ↑ +2H 2 O

Соединения хрома (III)
Cr 2 O 3
Оксид хрома () – тугоплавкий порошок темно-зеленого цвета.
Получение.
В лабораторных условиях термическим разложением
дихромата аммония:
t°
(NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 2H 2 O
В промышленности восстановлением дихромата калия
коксом или серой:
t°
K 2 Cr 2 O 7 + 3C = 2Cr 2 O 3 + 2K 2 CO 3 + CO 2
t°
K 2 Cr 2 O 7 + S = 2Cr 2 O 3 + K 2 SO 4

Оксид хрома (III) обладает амфотерными свойствами
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции оксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД.
Cr 2 O 3 + 6HCl = 2CrCl 3 + 3H 2 O
Cr 2 O 3 + 6H + + 6Cl – = 2Cr 3+ + 6Cl – + 3H 2 O
Cr 2 O 3 + 6H + = 2Cr 3+ + 3H 2 O

При сплавлении оксида хрома (III) с оксидами,
гидроксидами и карбонатами щелочных и
щелочноземельных металлов образуются
хроматы (III) (хромиты):
t°
Сr 2 O 3 + Ba(OH) 2 = Ba(CrO 2 ) 2 + H 2 O
t°
Сr 2 O 3 + Na 2 CO 3 = 2NaCrO 2 + CO 2
Оксид хрома (III) нерастворим в воде.

В окислительно-восстановительных реакциях оксид хрома (III)
ведет себя как восстановитель:
Cr 2 O 3 + KOH + KMnO 4 → K 2 CrO 4 + MnO 2 + H 2 O
Cr 2 O 3 + KOH + Сa(ClO) 2 → K 2 CrO 4 + CaCl 2 + H 2 O
Cr 2 O 3 + O 2 + Na 2 CO 3 → Na 2 CrO 4 + CO 2
Cr 2 O 3 + KClO 3 + Na 2 CO 3 → Na 2 CrO 4 + KCl + CO 2
Cr 2 O 3 + NaNO 3 + Na 2 CO 3 → Na 2 CrO 4 + NaNO 2 + CO 2
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
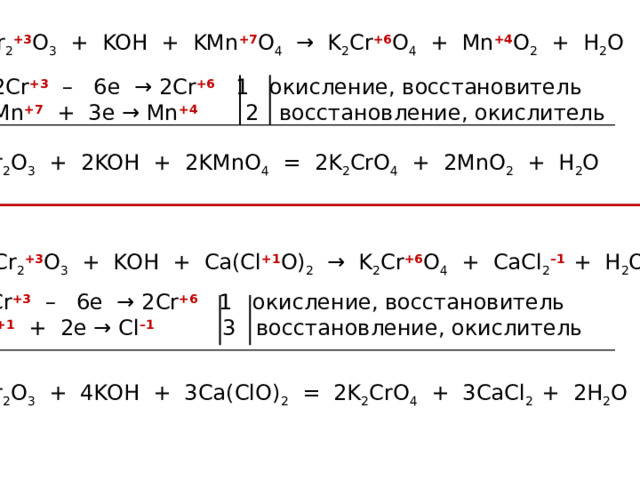
Cr 2 +3 O 3 + KOH + KMn +7 O 4 → K 2 Cr +6 O 4 + Mn +4 O 2 + H 2 O
2Cr +3 – 6e → 2Cr +6 1 окисление, восстановитель
Mn +7 + 3e → Mn +4 2 восстановление, окислитель
Cr 2 O 3 + 2KOH + 2KMnO 4 = 2K 2 CrO 4 + 2MnO 2 + H 2 O
Cr 2 +3 O 3 + KOH + Сa(Cl +1 O) 2 → K 2 Cr +6 O 4 + CaCl 2 –1 + H 2 O
2Cr +3 – 6e → 2Cr +6 1 окисление, восстановитель
Cl +1 + 2e → Cl –1 3 восстановление, окислитель
Cr 2 O 3 + 4KOH + 3Сa(ClO) 2 = 2K 2 CrO 4 + 3CaCl 2 + 2H 2 O
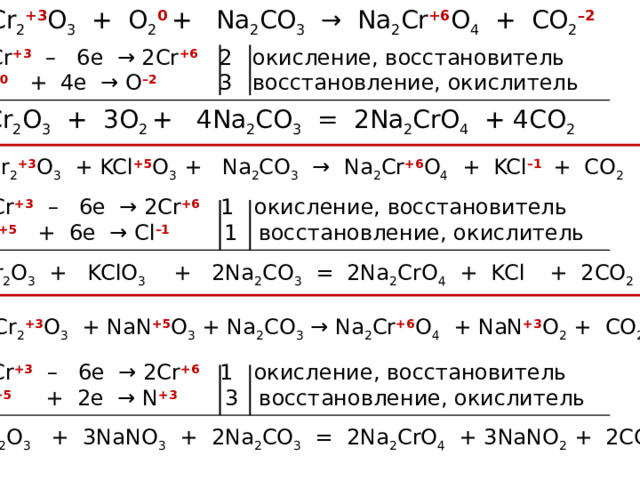
Cr 2 +3 O 3 + O 2 0 + Na 2 CO 3 → Na 2 Cr +6 O 4 + CO 2 –2
2Cr +3 – 6e → 2Cr +6 2 окисление, восстановитель
O 2 0 + 4e → O –2 3 восстановление, окислитель
Cr 2 O 3 + 3O 2 + 4Na 2 CO 3 = 2Na 2 CrO 4 + 4CO 2
Cr 2 +3 O 3 + KCl +5 O 3 + Na 2 CO 3 → Na 2 Cr +6 O 4 + KCl –1 + CO 2
2Cr +3 – 6e → 2Cr +6 1 окисление, восстановитель
Cl +5 + 6e → Cl –1 1 восстановление, окислитель
Cr 2 O 3 + KClO 3 + 2Na 2 CO 3 = 2Na 2 CrO 4 + KCl + 2CO 2
Cr 2 +3 O 3 + NaN +5 O 3 + Na 2 CO 3 → Na 2 Cr +6 O 4 + NaN +3 O 2 + CO 2
2Cr +3 – 6e → 2Cr +6 1 окисление, восстановитель
N +5 + 2e → N +3 3 восстановление, окислитель
Cr 2 O 3 + 3NaNO 3 + 2Na 2 CO 3 = 2Na 2 CrO 4 + 3NaNO 2 + 2CO 2

Оксид хрома (III) – катализатор
В присутствии оксида хрома (III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота .
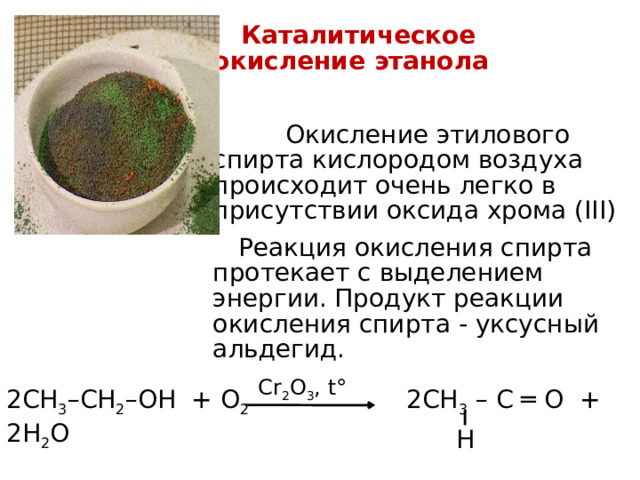
Каталитическое окисление этанола
Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома (III)
Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта - уксусный альдегид.
Cr 2 O 3 , t°
2СН 3 –СН 2 –ОН + О 2 2СН 3 – С ═ О + 2H 2 O
H

Гидроксид хрома (III)
Cr(OH) 3
Получают гидроксид хрома (III) действием
растворов щелочей или аммиака на растворы
солей хрома (III).
Лабораторный опыт № 1
К раствору хлорида хрома (III) прилейте раствор
аммиака. Что наблюдаете?
Составьте уравнение реакции получения
Cr(OH) 3 действием раствора аммиака на
хлорид хрома (III):
CrCl 3 + 3(NH 3 ·H 2 O) = Cr(OH) 3 + 3NH 4 Cl
![Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)? HCl CrCl 3 NaOH Cr(OH) 3 Na 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img47.jpg)
Лабораторный опыт № 2
Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте раствор соляной кислоты, а к другой –
щелочь. Что происходит?
Какими свойствами обладает гидроксид хрома (III)?
HCl
CrCl 3
NaOH
Cr(OH) 3
Na 3 [Cr(OH) 6 ]

Осадок, полученный в опыте № 1 разделите на две части, к
одной из них добавьте серной кислоты, а к другой – щелочь.
Что происходит?
+H 2 SO 4
+NaOH

Гидроксид хрома (III) обладает амфотерными свойствами.
При взаимодействии с кислотами образуются соли хрома (III):
Составьте уравнение реакции гидроксида хрома (III) с соляной
кислотой. Рассмотрите реакцию с точки зрения ТЕД .
Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O
Cr(OH) 3 + 3H + + 3Cl – = Cr 3+ + 3Cl – + 3H 2 O
Cr(OH) 3 + 3H + = Cr 3+ + 3H 2 O
![Гидроксид хрома (III) растворяется в щелочах Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ] гексагидроксохромат (III) натрия (изумрудно-зеленый) Cr(OH) 3 + 3Na + + 3OH – = 3Na + + [Cr(OH) 6 ] 3– Cr(OH) 3 + 3OH – = [Cr(OH) 6 ] 3– При нагревании гидроксид хрома (III) разлагается: t° 2Cr(OH) 3 = Cr 2 O 3 + 3H 2 O](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img50.jpg)
Гидроксид хрома (III) растворяется в щелочах
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]
гексагидроксохромат (III) натрия
(изумрудно-зеленый)
Cr(OH) 3 + 3Na + + 3OH – = 3Na + + [Cr(OH) 6 ] 3–
Cr(OH) 3 + 3OH – = [Cr(OH) 6 ] 3–
При нагревании гидроксид хрома (III) разлагается:
t°
2Cr(OH) 3 = Cr 2 O 3 + 3H 2 O
![Соли хрома (III) Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами: недостаток кислоты: NaCrO 2 + HCl + H 2 O = Cr(OH) 3 + NaCl избыток кислоты: NaCrO 2 + 4HCl = CrCl 3 + NaCl + 2H 2 O с угольной кислотой Na 3 [Cr(OH) 6 ] + 3CO 2 = Cr(OH) 3 + 3NaHCO 3 В растворе подвергаются полному гидролизу: Cr 2 S 3 + 6H 2 O = 2Cr(OH) 3 + 3H 2 S В водных растворах катион Cr 3+ встречается только в виде гидратированного иона [Cr(H 2 O) 6 ] 3+ , который придает раствору сине-фиолетовый цвет.](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img51.jpg)
Соли хрома (III)
Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами:
недостаток кислоты:
NaCrO 2 + HCl + H 2 O = Cr(OH) 3 + NaCl
избыток кислоты:
NaCrO 2 + 4HCl = CrCl 3 + NaCl + 2H 2 O
с угольной кислотой
Na 3 [Cr(OH) 6 ] + 3CO 2 = Cr(OH) 3 + 3NaHCO 3
В растворе подвергаются полному гидролизу:
Cr 2 S 3 + 6H 2 O = 2Cr(OH) 3 + 3H 2 S
В водных растворах катион Cr 3+ встречается только
в виде гидратированного иона [Cr(H 2 O) 6 ] 3+ , который
придает раствору сине-фиолетовый цвет.

Сульфат хрома (III) образует двойные соли – хромовые квасцы.
Из смешанного раствора сульфата хрома (III) и сульфата калия
кристаллизуется двойная соль – KCr(SO 4 ) 2 ·12H 2 O
сине-фиолетового цвета.
Применяются в качестве дубящего вещества при
изготовлении эмульсий, а также в дубящих растворах
и дубящих фиксажах.
![Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. K 3 [Cr(OH) 6 ] + Br 2 + KOH → K 2 CrO 4 + KBr + H 2 O CrCl 3 + Zn → CrCl 2 + ZnCl 2 KCrO 2 + PbO 2 + KOH → K 2 CrO 4 + K 2 PbO 2 + H 2 O CrCl 3 + H 2 O 2 + KOH → K 2 CrO 4 + KCl + H 2 O Cr 2 (SO 4 ) 3 + Cl 2 + NaOH → Na 2 CrO 4 + NaCl + H 2 O + Na 2 SO 4 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель.](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img53.jpg)
Соединения хрома (III) могут проявлять как окислительные
так и восстановительные свойства.
K 3 [Cr(OH) 6 ] + Br 2 + KOH → K 2 CrO 4 + KBr + H 2 O
CrCl 3 + Zn → CrCl 2 + ZnCl 2
KCrO 2 + PbO 2 + KOH → K 2 CrO 4 + K 2 PbO 2 + H 2 O
CrCl 3 + H 2 O 2 + KOH → K 2 CrO 4 + KCl + H 2 O
Cr 2 (SO 4 ) 3 + Cl 2 + NaOH → Na 2 CrO 4 + NaCl + H 2 O + Na 2 SO 4
Рассмотрите эти реакции как окислительно-восстановительные
Расставьте коэффициенты.
Назовите окислитель и восстановитель.
![K 3 [Cr +3 (OH) 6 ] + Br 2 0 + KOH → K 2 Cr +6 O 4 + KBr – + H 2 O Cr +3 – 3e → Cr +6 2 окисление, восстановитель Br 2 0 + 2e → 2Br –1 3 восстановление, окислитель 2K 3 [Cr(OH) 6 ] + 3Br 2 + 4KOH = 2K 2 CrO 4 + 6KBr + 8H 2 O Cr +3 Cl 3 + Zn 0 → Cr +2 Cl 2 + Zn +2 Cl 2 Cr +3 + 1e → Cr +2 2 восстановление, окислитель Zn 0 – 2e → Zn +2 1 окисление, восстановитель 2CrCl 3 + Zn = 2CrCl 2 + ZnCl 2 KCr +3 O 2 + Pb +4 O 2 + KOH → K 2 Cr +6 O 4 + K 2 Pb +2 O 2 + H 2 O Cr +3 – 3e → Cr +6 2 окисление, восстановитель Pb +4 + 2e → Pb –2 3 восстановление, окислитель 2KCrO 2 + 3PbO 2 + 8KOH = 2K 2 CrO 4 + 3K 2 PbO 2 + 4H 2 O](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img54.jpg)
K 3 [Cr +3 (OH) 6 ] + Br 2 0 + KOH → K 2 Cr +6 O 4 + KBr – + H 2 O
Cr +3 – 3e → Cr +6 2 окисление, восстановитель
Br 2 0 + 2e → 2Br –1 3 восстановление, окислитель
2K 3 [Cr(OH) 6 ] + 3Br 2 + 4KOH = 2K 2 CrO 4 + 6KBr + 8H 2 O
Cr +3 Cl 3 + Zn 0 → Cr +2 Cl 2 + Zn +2 Cl 2
Cr +3 + 1e → Cr +2 2 восстановление, окислитель
Zn 0 – 2e → Zn +2 1 окисление, восстановитель
2CrCl 3 + Zn = 2CrCl 2 + ZnCl 2
KCr +3 O 2 + Pb +4 O 2 + KOH → K 2 Cr +6 O 4 + K 2 Pb +2 O 2 + H 2 O
Cr +3 – 3e → Cr +6 2 окисление, восстановитель
Pb +4 + 2e → Pb –2 3 восстановление, окислитель
2KCrO 2 + 3PbO 2 + 8KOH = 2K 2 CrO 4 + 3K 2 PbO 2 + 4H 2 O
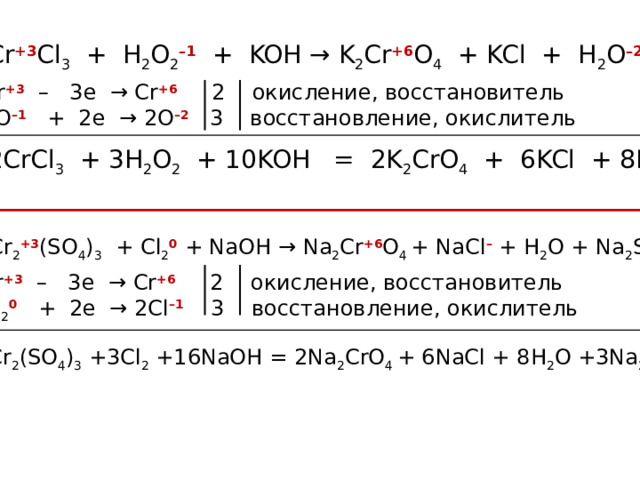
Cr +3 Cl 3 + H 2 O 2 –1 + KOH → K 2 Cr +6 O 4 + KCl + H 2 O –2
Cr +3 – 3e → Cr +6 2 окисление, восстановитель
2O –1 + 2e → 2O –2 3 восстановление, окислитель
2CrCl 3 + 3H 2 O 2 + 10KOH = 2K 2 CrO 4 + 6KCl + 8H 2 O
Cr 2 +3 (SO 4 ) 3 + Cl 2 0 + NaOH → Na 2 Cr +6 O 4 + NaCl – + H 2 O + Na 2 SO 4
Cr +3 – 3e → Cr +6 2 окисление, восстановитель
Cl 2 0 + 2e → 2Cl –1 3 восстановление, окислитель
Cr 2 (SO 4 ) 3 +3Cl 2 +16NaOH = 2Na 2 CrO 4 + 6NaCl + 8H 2 O +3Na 2 SO 4

Оксид хрома (VI) CrO 3 — хромовый ангидрид,
представляет собой темно-красные
игольчатые кристаллы.
Получают CrO 3 действием избытка
концентрированной серной кислоты
на насыщенный водный раствор
дихромата натрия:
Na 2 Cr 2 O 7 + 2H 2 SO 4 = 2 CrO 3 + 2NaHSO 4 + H 2 O
При нагревании выше 250 °C разлагается:
4CrO 3 → 2Cr 2 O 3 + 3O 2 ↑.
Оксид хрома (VI) очень ядовит .

CrO 3 — кислотный оксид .
При растворении в воде образует кислоты.
С избытком воды образуется хромовая
кислота H 2 CrO 4
CrO 3 + Н 2 O = Н 2 CrO 4
При большой концентрации CrO 3 образуется дихромовая
кислота Н 2 Cr 2 О 7
2CrO 3 + Н 2 O = Н 2 Cr 2 O 7
которая при разбавлении переходит в хромовую кислоту :
Н 2 Cr 2 О 7 + Н 2 О = 2Н 2 CrO 4
Эти кислоты – неустойчивые. Существуют только в растворе.
Между ними в растворе устанавливается равновесие
2Н 2 CrO 4 ↔ Н 2 Cr 2 O 7 + Н 2 O
При взаимодействии CrO 3 со щелочами образуются хроматы
CrO 3 + 2KOH → K 2 CrO 4 + H 2 O.

CrO 3 является сильным окислителем
Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним.
CrO 3 + C 2 H 5 OH → CO 2 + Cr 2 O 3 + H 2 O
C 2 H 5 OH + 3H 2 O – 12e → 2CO 2 + 12H + 1
2CrO 3 + 6H + + 6e → Cr 2 O 3 + 3H 2 O 2
C 2 H 5 OH + 3H 2 O + 4CrO 3 + 12H + = 2CO 2 + 12H + + 2Cr 2 O 3 + 6H 2 O
4CrO 3 + C 2 H 5 OH → 2CO 2 + 2Cr 2 O 3 + 3H 2 O
Окисляет йод, серу, фосфор, уголь.
4CrO 3 + 3S = 2Cr 2 O 3 + 3SO 2 ↑.
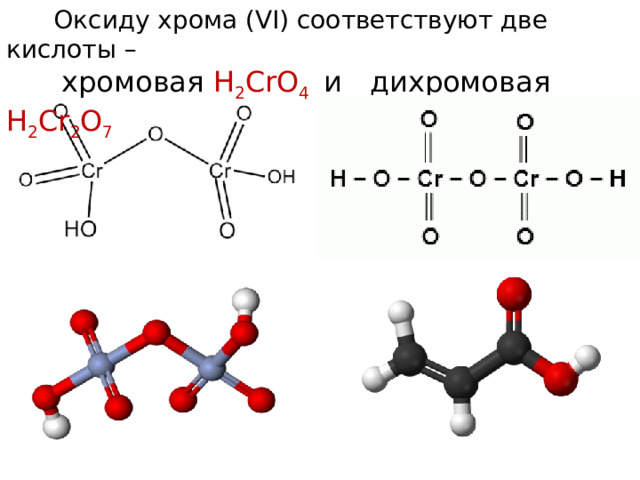
Оксиду хрома (VI) соответствуют две кислоты –
хромовая Н 2 CrO 4 и дихромовая Н 2 Cr 2 O 7

Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO 3 ; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет

соли
хроматы – соли хромовой кислоты устойчивы в щелочной среде, при
подкислении переходят в оранжевые
дихроматы , соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается.
2CrO 4 2– + 2H+ ↔ Cr 2 O 7 2– + H 2 O
Н +
дихроматы
хроматы
ОН –

Лабораторный опыт № 3
К раствору дихромата калия добавьте гидроксид калия.
Как изменилась окраска? Чем это вызвано?
К полученному раствору добавьте
серной кислоты до восстановления
желтой окраски.
Напишите уравнения реакций.

2K 2 CrO 4 + H 2 SO 4(разб.) = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
2K 2 CrO 4 + 2HCl (разб.) = K 2 Cr 2 O 7 + 2KCl + H 2 O
2K 2 CrO 4 + H 2 O + CO 2 = K 2 Cr 2 O 7 + KHCO 3
K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O

Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют две кислоты – хромовая Н 2 CrO 4 и дихромовая Н 2 Cr 2 O 7, Хромат калия K 2 CrO 4 и дихромат калия K 2 Cr 2 O 7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.
2K 2 CrO 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы.
K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O
![Соединения хрома (VI) – сильные окислители Cr 3+ H+ Cr 2 O 7 2– + 14H + + 6e → 2Cr 3+ + 7H 2 O Cr 2 O 7 2– Cr(OH) 3 H 2 O OH – [Cr(OH) 6 ] 3– Cr 2 O 7 2– + 7Н 2 О + 6e → 2[Cr(OH) 6 ] 3– + 2ОН –](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img65.jpg)
Соединения хрома (VI) –
сильные окислители
Cr 3+
H+
Cr 2 O 7 2– + 14H + + 6e → 2Cr 3+ + 7H 2 O
Cr 2 O 7 2–
Cr(OH) 3
H 2 O
OH –
[Cr(OH) 6 ] 3–
Cr 2 O 7 2– + 7Н 2 О + 6e → 2[Cr(OH) 6 ] 3– + 2ОН –
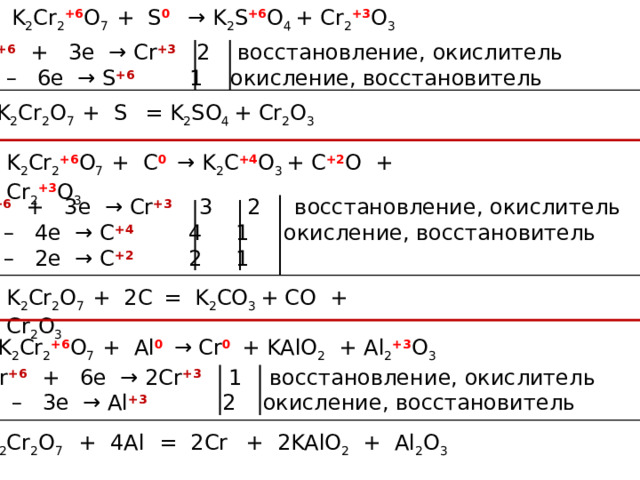
K 2 Cr 2 +6 O 7 + S 0 → K 2 S +6 O 4 + Cr 2 +3 O 3
Cr +6 + 3e → Cr +3 2 восстановление, окислитель
S 0 – 6e → S +6 1 окисление, восстановитель
K 2 Cr 2 O 7 + S = K 2 SO 4 + Cr 2 O 3
K 2 Cr 2 +6 O 7 + С 0 → K 2 С +4 O 3 + С +2 О + Cr 2 +3 O 3
Cr +6 + 3e → Cr +3 3 2 восстановление, окислитель
С 0 – 4e → С +4 4 1 окисление, восстановитель
С 0 – 2e → С +2 2 1
K 2 Cr 2 O 7 + 2С = K 2 СO 3 + СО + Cr 2 O 3
K 2 Cr 2 +6 O 7 + Al 0 → Cr 0 + KAlO 2 + Al 2 +3 O 3
2Cr +6 + 6e → 2Cr +3 1 восстановление, окислитель
Al 0 – 3e → Al +3 2 окисление, восстановитель
K 2 Cr 2 O 7 + 4Al = 2Cr + 2KAlO 2 + Al 2 O 3

Хроматы щелочных металлов плавятся без разложения, а
дихроматы при высокой температуре превращаются в хроматы.
Дихромат аммония разлагается при нагревании:
180°C
(NH 4 ) 2 Cr 2 O 7 Cr 2 O 3 + N 2 + 4H 2 O

В ряду гидроксидов хрома различных степеней окисления
Cr(ОН) 2 — Cr(ОН) 3 — Н 2 CrО 4
закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства.
Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III).
Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III).
Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
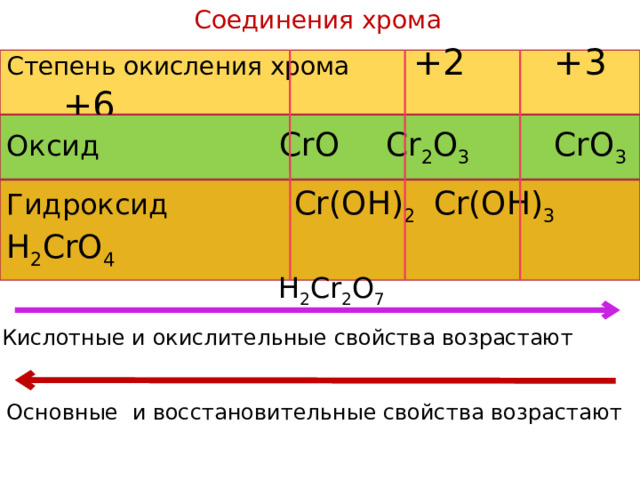
Соединения хрома
Степень окисления хромa +2 +3 +6
Оксид CrO Cr 2 O 3 CrO 3
Гидроксид Cr(OH) 2 Cr(OH) 3 H 2 CrO 4
H 2 Cr 2 O 7
Кислотные и окислительные свойства возрастают
Основные и восстановительные свойства возрастают

Вольфрам
Вольфрам — химический элемент с атомным номером 74 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом W
Самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек.
Хорошо поддается ковке и может быть вытянут в тонкую нить.
Был получен впервые испанцами братьями де Эльгуйяр, учениками Бергмана в 1783 г.
Было замеченно, что при прокаливании одной из оловянных руд значительное количество олова теряется, уходя в шлак.
Эта руда получила название волк (Wolf, или Wolfert), с течением времени изменилось на вольфрам; так стали называть минерал, содержащийся в руде.
Вольфрам — блестящий светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения
Химические свойства
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Растворяется в смеси азотной и плавиковой кислоты.
При 400-500°С компактный металл заметно окисляется на воздухе до WO 3 . Пары воды интенсивно окисляют его выше 600°С до WO 3
Вольфрам образует четыре оксида: высший - WO 3 (вольфрамовый ангидрид), низший - WO 2 и два промежуточных W 10 О 29 и W 4 O 11 .
Наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы.
Вольфраматы склонны к образованию полимерных анионов
Вольфрамовому ангидриду соответствует вольфрамовая кислота H 2 WO 4 - желтый порошок, практически не растворимый в воде и в кислотах. При ее взаимодействии с растворами щелочей и аммиака образуются растворы вольфраматов. При 188°С Н 2 WО 4 отщепляет воду с образованием WO 3 .
Вольфрамовый ангидрид - кристаллический порошок лимонно-желтого цвета, растворяющийся в растворах щелочей с образованием вольфраматов. При его восстановлении водородом последовательно образуются низшие оксиды и Вольфрам.

Галогены, сера, углерод, кремний, бор взаимодействуют с Вольфрамом при высоких температурах (фтор с порошкообразным Вольфрамом - при комнатной).
С водородом Вольфрам не реагирует вплоть до температуры плавления; с азотом выше 1500°С образует нитрид.
При обычных условиях Вольфрам стоек к соляной, серной, азотной и плавиковой кислотам, а также к царской водке; при 100°С слабо взаимодействует с ними.
В растворах щелочей при нагревании Вольфрам растворяется слегка, а в расплавленных щелочах при доступе воздуха или в присутствии окислителей - быстро; при этом образуются вольфраматы
- С серой Вольфрам образует два сульфида WS 2 и WS 3 . Карбиды вольфрама WC (t пл 2900°C) и W 2 C (t пл 2750°С) - твердые тугоплавкие соединения; получаются при взаимодействии Вольфрама с углеродом при 1000-1500°С.
С хлором Вольфрам образует ряд хлоридов и оксихлоридов. Наиболее важные из них: WCl 6 (t пл 275°С, t кип 348°C) и WO 2 Cl 2 (t пл 266°С, выше 300°С сублимирует), получаются при действии хлора на вольфрамовый ангидрид в присутствии угля.

Применение
Главное применение вольфрама — как основа тугоплавких материалов в металлургии
Ядерная физика, ядерная медицина,рентгеновское излучение
- Так же используется как катализатор , высоко-температурная смазка, пигмент.
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее.
Добывается 49—50 тысяч тонн в год.
Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.

Содержание в земной коре 3·10 −4 % по массе. В свободном виде молибден не встречается. В земной коре молибден распространён относительно равномерно. Концентрация молибдена в породах повышается по мере увеличения SiO 2 . Молибден находится также в морской и речной воде, в золе растений, в углях и нефти.
Молибде́н — элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo
Простое вещество молибден — переходный металл светло-серого цвета. Главное применение находит в металлургии.
Содержание молибдена в морской воде колеблется от 8,9 до 12,2 мкг/л для разных океанов и акваторий. Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах).

- В поверхностных условиях образуются преимущественно кислородные соединения Мо 6+ . В первичных рудах молибденит встречается в ассоциации с вольфрамитом и висмутином, с минералами меди (медно-порфировые руды), а также с галенитом, сфалеритом и урановой смолкой (в низкотемпературных гидротермальных месторождениях). Хотя молибденит считается устойчивым сульфидом по отношению к кислым и щелочным растворителям, в природных условиях при длительном воздействии воды и кислорода воздуха молибденит окисляется и молибден может интенсивно мигрировать с образованием вторичных минералов. Этим можно объяснить повышенные концентрации молибдена в осадочных отложениях — углистых и кремнисто-углистых сланцах и углях.
- Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS 2 (60 % Mo), повеллит СаМоО 4 (48 % Мо), молибдит Fe(MoO 4 ) 3 ·nH 2 O (60 % Mo) и вульфенит PbMoO 4 .

Физический свойства
Металлические свойства, как и у большинства металлов, определяются чистотой металла и предшествующей механической и термической обработкой (чем чище металл, тем он мягче). Обладает крайне низким коэффициентом теплового расширения
Молибден — светло-серый металл с кубической объёмноцентрированной решёткой типа
Шкала Мооса определяет его твердость 4.5 баллами.
Молибден является тугоплавким металлом c температурой плавления 2620 °C и температурой кипения — 4639 °C.
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида МоО 3 :
2MoS2+7O2 2MoO3+4SO2
который подвергают дополнительной очистке.
Далее МоО 3 восстанавливают водородом: MoO3+3H2 Mo+3H2O
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Химические свойства
При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400 °C. Выше 600 °C быстро окисляется до триоксида МоО 3 . Этот оксид получают также окислением дисульфида молибдена MoS 2 и термолизом молибдата аммония (NH 4 ) 6 Mo 7 O 24 ·4H 2 O.
Мо образует оксид молибдена (IV) МоО 2 и ряд оксидов, промежуточных между МоО 3 и МоО 2 .
- При нагревании молибдена с серой образуется дисульфид молибдена MoS 2 , с селеном — диселенид молибдена состава MoSe 2 . Известны карбиды молибдена Mo 2 C и MoC — кристаллические высокоплавкие вещества и силицид молибдена MoSi 2 .
С галогенами Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или МоО 3 с F 2 получают гексафторид молибдена MoF 6 , бесцветную легкокипящую жидкость. Mo (+4 и +5) образует твердые галогениды MoHal 4 и MoHal 5 (Hal = F, Cl, Br). С иодом известен только дийодид молибдена MoI 2 . Молибден образует оксигалогениды: MoOF 4 , MoOCl 4 , MoO 2 F 2 , MoO 2 Cl 2 , MoO 2 Br 2 , MoOBr 3 и другие.
Молибден обладает большим сходством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит
Особая группа соединений молибдена — молибденовые сини. При действии восстановителей — сернистого газа, цинковой пыли, алюминия или других на слабокислые (рН=4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Мо 2 О 5 ·Н 2 О, Мо 4 О 11 ·Н 2 О и Мо 8 О 23 ·8Н 2 О.
Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, хН 2 О· уМоО 3 (парамолибдат аммония 3(NH 4 ) 2 O·7MoO 3 ·zH 2 O; СаМоО 4 , Fe 2 (МоО 4 ) 3 — встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки [МоО 4 ].
Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, М +1 М +3 (МоО 4 ) 2 , М +1 5 М +3 (МоО 4 ) 4 . Оксидные соединения, содержащие молибден в низших степенях окисления — молибденовые бронзы, например, красная K 0,26 MoO 3 и синяя К 0,28 МоО 3 . Эти соединения обладают металлической проводимостью и полупроводниковыми свойствами.
При подкислении водных растворов нормальных молибдатов образуются ионы MoO 3 OH − , затем ионы полимолибдатов: гепта-, (пара-) Мо 7 О 26 6− , тетра-(мета-) Мо 4 О 13 2− , окта- Мо 8 О 26 4− и другие. Безводные полимолибдаты синтезируют спеканием МоО 3 с оксидами металлов.
Применение
Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампочках.
Молибден используется для легирования сталей, как компонент жаропрочных и коррозионностойких сплавов.
Молибден — один из немногих легирующих элементов, способных одновременно повысить прочностные, вязкие свойства стали и коррозионную стойкость. Обычно при легировании одновременно с увеличением прочности растет и хрупкость металла. Известны случаи использования молибден
Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS 2 используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93 Mo (T 1/2 6,95ч) и 99 Mo (T 1/2 66ч) — изотопные индикаторы.
- Молибден-99 используется для получения технеция-99, который используется в медицине при диагностике онкологических и некоторых других заболеваний. Общее мировое производство молибдена-99 составляет около 12 000 Кюри в неделю (из расчёта активности на шестой день), стоимость молибдена-99 — 46 млн долларов за 1 грамм (470 долларов за 1 Ки).












































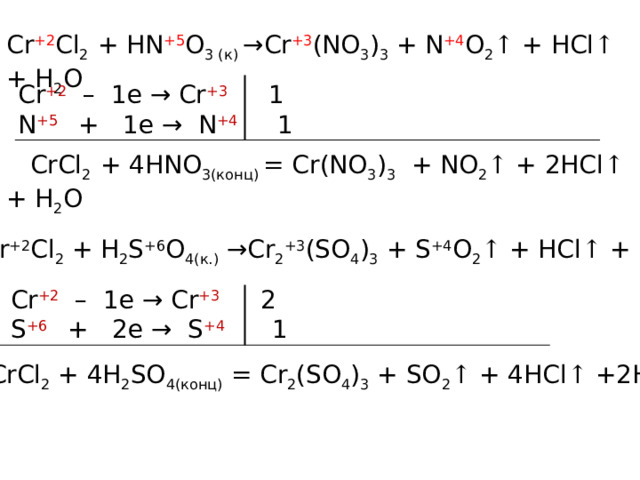









![Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома (III)? HCl CrCl 3 NaOH Cr(OH) 3 Na 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img47.jpg)


![Гидроксид хрома (III) растворяется в щелочах Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ] гексагидроксохромат (III) натрия (изумрудно-зеленый) Cr(OH) 3 + 3Na + + 3OH – = 3Na + + [Cr(OH) 6 ] 3– Cr(OH) 3 + 3OH – = [Cr(OH) 6 ] 3– При нагревании гидроксид хрома (III) разлагается: t° 2Cr(OH) 3 = Cr 2 O 3 + 3H 2 O](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img50.jpg)
![Соли хрома (III) Хроматы (III) устойчивы в щелочной среде. Они легко реагируют с кислотами: недостаток кислоты: NaCrO 2 + HCl + H 2 O = Cr(OH) 3 + NaCl избыток кислоты: NaCrO 2 + 4HCl = CrCl 3 + NaCl + 2H 2 O с угольной кислотой Na 3 [Cr(OH) 6 ] + 3CO 2 = Cr(OH) 3 + 3NaHCO 3 В растворе подвергаются полному гидролизу: Cr 2 S 3 + 6H 2 O = 2Cr(OH) 3 + 3H 2 S В водных растворах катион Cr 3+ встречается только в виде гидратированного иона [Cr(H 2 O) 6 ] 3+ , который придает раствору сине-фиолетовый цвет.](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img51.jpg)

![Соединения хрома (III) могут проявлять как окислительные так и восстановительные свойства. K 3 [Cr(OH) 6 ] + Br 2 + KOH → K 2 CrO 4 + KBr + H 2 O CrCl 3 + Zn → CrCl 2 + ZnCl 2 KCrO 2 + PbO 2 + KOH → K 2 CrO 4 + K 2 PbO 2 + H 2 O CrCl 3 + H 2 O 2 + KOH → K 2 CrO 4 + KCl + H 2 O Cr 2 (SO 4 ) 3 + Cl 2 + NaOH → Na 2 CrO 4 + NaCl + H 2 O + Na 2 SO 4 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель.](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img53.jpg)
![K 3 [Cr +3 (OH) 6 ] + Br 2 0 + KOH → K 2 Cr +6 O 4 + KBr – + H 2 O Cr +3 – 3e → Cr +6 2 окисление, восстановитель Br 2 0 + 2e → 2Br –1 3 восстановление, окислитель 2K 3 [Cr(OH) 6 ] + 3Br 2 + 4KOH = 2K 2 CrO 4 + 6KBr + 8H 2 O Cr +3 Cl 3 + Zn 0 → Cr +2 Cl 2 + Zn +2 Cl 2 Cr +3 + 1e → Cr +2 2 восстановление, окислитель Zn 0 – 2e → Zn +2 1 окисление, восстановитель 2CrCl 3 + Zn = 2CrCl 2 + ZnCl 2 KCr +3 O 2 + Pb +4 O 2 + KOH → K 2 Cr +6 O 4 + K 2 Pb +2 O 2 + H 2 O Cr +3 – 3e → Cr +6 2 окисление, восстановитель Pb +4 + 2e → Pb –2 3 восстановление, окислитель 2KCrO 2 + 3PbO 2 + 8KOH = 2K 2 CrO 4 + 3K 2 PbO 2 + 4H 2 O](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img54.jpg)










![Соединения хрома (VI) – сильные окислители Cr 3+ H+ Cr 2 O 7 2– + 14H + + 6e → 2Cr 3+ + 7H 2 O Cr 2 O 7 2– Cr(OH) 3 H 2 O OH – [Cr(OH) 6 ] 3– Cr 2 O 7 2– + 7Н 2 О + 6e → 2[Cr(OH) 6 ] 3– + 2ОН –](https://fsd.multiurok.ru/html/2023/03/30/s_6425d21f35fbe/img65.jpg)




















