
Тема урока: «Кислоты» 8 класс
р
Разработала учитель – Волвенкина Е.И.
МКОУ Россошанская школа
Репьёвский р-н Воронежской области
р

Цель урока: формирование представления учащихся о кислотах.
Задачи урок а:
- 1. Образовательная: изучить состав, строение, классификацию и свойства кислот.
- 2. Развивающие :
а) учебно-познавательные: развитие умения добывать знания, выделять главное, обобщать, делать выводы;
б) коммуникативные: развитие навыков взаимодействия с другими людьми, умения ответить на поставленный вопрос;
в) информационные: выделять существенные признаки химических реакций, извлекать необходимую информацию из проводимого эксперимента; оформлять и представлять результаты своей работы.
- 3. Воспитательные: воспитывать сознательное отношение к учебному труду, чувство ответственности, развивать интерес к знаниям.
- 4. Здоровьесберегающие : закрепить навыки безопасного обращения с реактивами и кислотами, с которыми часто имеют дело в повседневной жизни.

Оборудование и реактивы:
- Оборудование:
- мультимедийная презентация (ПК, проектор);
- штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, химические стаканы, белый экран для демонстрации опытов;
- памятка по ТБ при работе с кислотами (на каждую пару учащихся);
- учебник Г. Е. Рудзитис «Химия. Неорганическая химия. 8 класс» М.: Просвещение, 2010.
- Реактивы:
- Индикаторы: лакмус, метилоранж, фенолфталеин;
- Кислоты: соляная и серная;
- Металлы: цинк, железо, медь;
- Оксид меди (II);
- Гидроксид натрия;
- Соли: сульфат меди (II), хлорид бария, карбонат кальция.

План урока:
- I. Организационный момент.
- II. Повторение:
- известные классы веществ.
- III. Изучение нового материала:
- определение кислот;
- кислоты вокруг нас;
- знакомство с формулами кислот;
- классификация кислот;
- физические свойства кислот;
- общие химические свойства кислот.
- IV. Закрепление.
- V. Подведение итогов.
- VI. Домашнее задание.

Девиз урока:
То, что мы знаем, - ограничено; То, что не знаем, - бесконечно. П. Лаплас

Из данных веществ выберите формулы оксидов и оснований
P 2 O 5 , Cu(OH) 2 , HCl
HNO 3 , H 2 SO 4 , Ca(OH) 2 ,
SO 3 , Al 2 O 3 , Zn(OH) 2 .
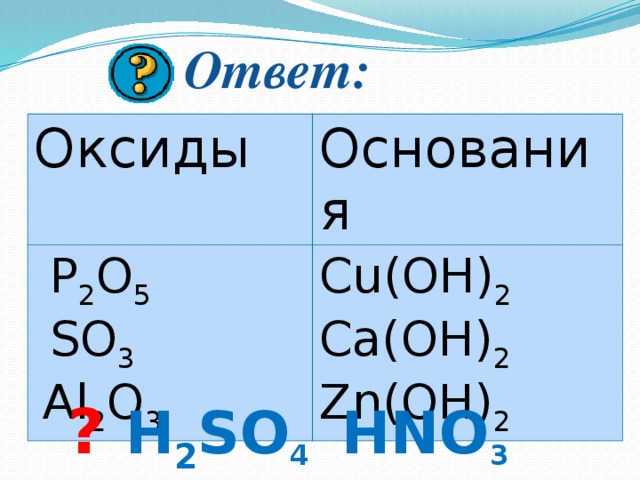
Ответ:
Оксиды
Основания
P 2 O 5
SO 3
Cu(OH) 2 Ca(OH) 2 Zn(OH) 2
Al 2 O 3
- Кликом мышки вызываем задание.
- Кликом мышки вызывам правильный ответ с целью самопроверки.
- Кликом мышки вызываем вопрос.
? H 2 SO 4 HNO 3 HCl

Подумайте! Какой класс химических веществ мы будем изучать?
www.undersky.ru
images.yandex.ru
www.clipart.net.ua

Цель урока:
Сформировать представление о кислотах
Классификация
Название
Кликом мышки открываем цели урока после формулировки их учащимися.
Определение с помощью индикаторов
Состав
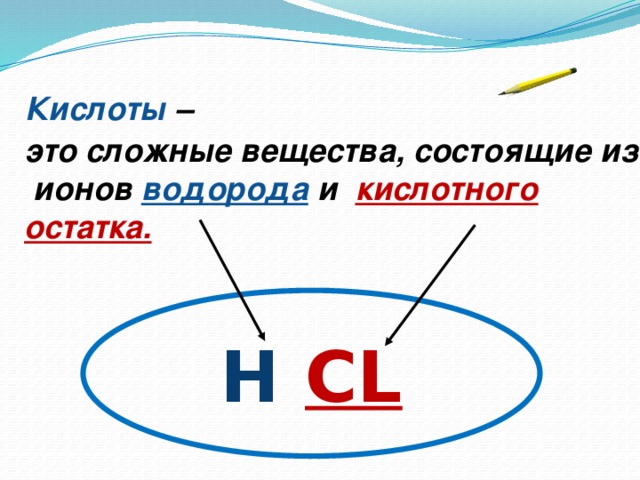
Кислоты – это сложные вещества, состоящие из ионов водорода и кислотного остатка.
Н CL

Кислоты в нашей жизни
Думаю, чо не приукрашу, Если хвалить буду я простоквашу. Есть в ней молочная кислота – Молодость ваша и красота.
Жуйте лимон, если горло болит
Сок чудотворный вас исцелит.
Есть в муравьях и крапиве невинная,
С пользой для нас – кислота муравьиная.
Жжет она кожу, но есть в ней и прок –
Ваш ревматизм она вылечит в срок.

Формула
Название
H 2 SO 4
Кислотный остаток
Сер ная
H 2 SO 3
H CL
Серн истая
=SO 4
=SO 3
Хлор о водородная (соляная)
H 2 SiO 3
− CL
Кремниевая
H 3 PO 4
H NO 3
=SiO 3
Фосфор ная
≡ PO 4
Азот ная
H NO 2
− NO 3
Азот истая
H 2 CO 3
− NO 2
Уголь ная
H 2 S
=CO 3
Сер о водородная
=S

Подчеркните кислотный остаток в молекулах кислот
H 2 SO 4 ; H 2 CO 3 ; HNO 3 ; H 2 SiO 3 ; H 3 PO 4

Определите валентность кислотных остатков
II
II
I
H 2 SO 4 ; H 2 CO 3 ; H NO 3 ;
II
III
H 2 SiO 3 ; H 3 PO 4
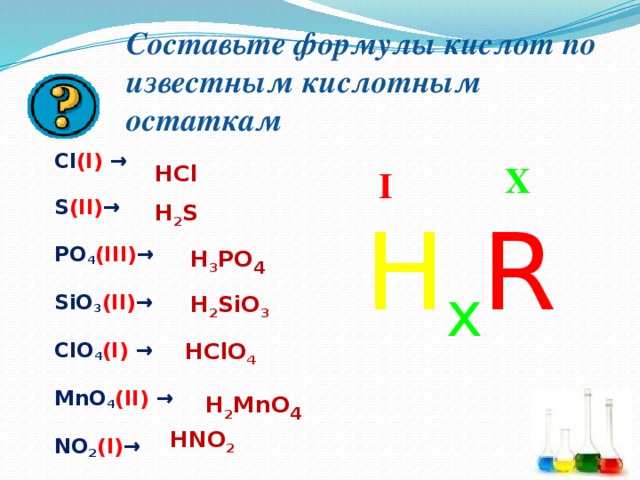
Составьте формулы кислот по известным кислотным остаткам
Cl (I) →
S (II) →
PO 4 (III) →
SiO 3 (II) →
ClO 4 (I) →
MnO 4 (II) →
NO 2 (I) →
HCl
X
I
H 2 S
H x R
H 3 PO 4
H 2 SiO 3
HClO 4
H 2 MnO 4
HNO 2

Классификация кислот
По какому признаку кислоты разделены на группы?
HNO 3 - азотная
HF - фтороводородная
HNO 2 - азотистая
HCl - хлороводородная
HClO 4 - хлорная
HBr - бромоводородная
HI - йодоводородная
H 2 SO 4 - серная
H 2 SO 3 - сернистая
H 2 S - сероводородная
H 2 CO 3 - угольная
H 2 SiO 3 - кремниевая
H 3 PO 4 - фосфорная
H 3 BO 3 - борная

Классификация кислот
По какому признаку кислоты разделены на группы?
H 2 S - сероводородная
HF - фтороводородная
HCl - хлороводородная
H 2 SO 4 - серная
HBr - бромоводородная
H 2 SO 3 - сернистая
HI - йодоводородная
H 2 CO 3 - угольная
H 2 SiO 3 - кремниевая
HNO 3 - азотная
HNO 2 - азотистая
HClO 4 - хлорная
H 3 PO 4 - фосфорная
H 3 BO 3 - борная

Это интересно!
Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии у И. Глаубера, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провел серию опытов с разными кислотами и цветами разных растений. Оказалось, что и васильки, и роза, и цветки некоторых других растений изменяли свою окраску при действии кислот.
Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворах кислот он становился красным, а в растворах щелочей - синим.
- После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот и оснований.

Техника безопасности
Кликом мышки поочередно вызываем материал по техники безопасности.

Техника безопасности
Помните, что любое вещество может быть
опасным, если
обращаться
с ним неправильно!

Техника безопасности
Никогда не добавляйте воду в кислоту!

Техника безопасности
Юные химики, помните:
кислоту добавляют в воду, а не наоборот!

Памятка по ТБ при работе с кислотами:
- 1. Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
- 2. Заполнять пробирку можно только на 1/3 объема.
- 3. Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем.
- 4.При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать концентрированную кислоту с водой следует с большой осторожностью: надо вливать серную кислоту в воду, а не наоборот. Если вливать воду в серную кислоту, то часть воды за счет выделения теплоты может нагреться до кипения. Кислота начнет разбрызгиваться и может попасть на кожу, в глаза.
- 5.Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем раствором питьевой соды и вновь смыть водой.

Химические свойства кислот
- 1. Водные растворы кислот реагируют с индикаторами.
- 2. Характерным свойством кислот является взаимодействие с металлами.
- 3. Кислоты способны реагировать с основными оксидами .
- 4. Кислоты способны реагировать с основаниями.
- 5. Кислоты вступают в реакцию с солями.

1. Выберите бескислородные кислоты.
H 3 PO 4
HNO 3
HCl
H 2 S
H 2 CO 3
H 2 SO 3
H 2 SO 4
H 2 SiO 3
HNO 2
- Кликом мышки вызываем вопрос.
- Для поверки ответа нажимаем мышкой на кнопку в правом нижнем углу.
- Для появления следующего вопроса, кликаем мышкой на экран и нажимая на кнопку в правом нижнем углу вызываем ответ после обсуждения его в группах в течении 1 минуты и сдачи правильного ответа учителю.
- После ответов на семь вопросов кликом мышки нажимаем на стрелку в нижнем левом углу для перехода к следующему слайду.

2. Выберите двухосновные кислоты.
H 3 PO 4
HNO 3
HCl
H 2 S
H 2 CO 3
H 2 SO 3
H 2 SO 4
H 2 SiO 3
HNO 2

3. Выберите трехосновные кислоты.
H 3 PO 4
HNO 3
HCl
H 2 S
H 2 CO 3
H 2 SO 3
H 2 SO 4
H 2 SiO 3
HNO 2

4.Выберите одноосновные кислородсодержащие кислоты.
H 3 PO 4
HNO 3
HCl
H 2 S
H 2 CO 3
H 2 SO 3
H 2 SO 4
H 2 SiO 3
HNO 2
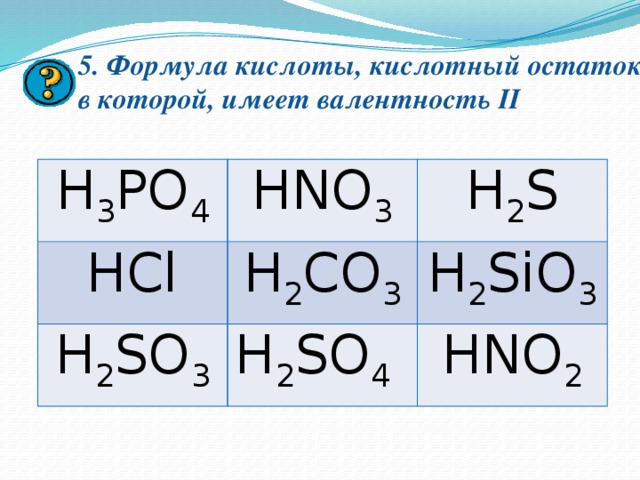
5. Формула кислоты, кислотный остаток в которой, имеет валентность II
H 3 PO 4
HNO 3
HCl
H 2 S
H 2 CO 3
H 2 SO 3
H 2 SO 4
H 2 SiO 3
HNO 2

Ответы:
1. HCl, H 2 S
2. H 2 CO 3 H 2 SiO 3 H 2 S H 2 SO 3 H 2 SO 4
3. H 3 PO 4
- Кликом мышки вызываем правильные ответы.
- Для возврата на поле вопросов, нажмите на кнопку в правом нижнем углу.
4. HNO 3 HNO 2
5. H 2 SO 3 H 2 SO 4 H 2 SiO 3 H 2 S H 2 CO 3

Домашнее задание:
§ 32, выучить названия кислот,
задача №1, вопрос № 8 (второй столбик).
![Используемые ресурсы: http://school-collection.edu.ru/catalog/pupil/?%20subject[]=31%20class[]=50%20class[]=51%20class[]=53%20class[]=54 Единая коллекция ЦОР http://vmirhimii.ucoz.ru/ персональный сайт Пономаревой Е.А. (Игры-тренажеры, тесты)](https://fsd.multiurok.ru/html/2017/01/17/s_587e4d0c88e6e/img31.jpg)
Используемые ресурсы:
http://school-collection.edu.ru/catalog/pupil/?%20subject[]=31%20class[]=50%20class[]=51%20class[]=53%20class[]=54 Единая коллекция ЦОР
http://vmirhimii.ucoz.ru/ персональный сайт Пономаревой Е.А. (Игры-тренажеры, тесты)





































![Используемые ресурсы: http://school-collection.edu.ru/catalog/pupil/?%20subject[]=31%20class[]=50%20class[]=51%20class[]=53%20class[]=54 Единая коллекция ЦОР http://vmirhimii.ucoz.ru/ персональный сайт Пономаревой Е.А. (Игры-тренажеры, тесты)](https://fsd.multiurok.ru/html/2017/01/17/s_587e4d0c88e6e/img31.jpg)










