Фосфор и его соединения
Цели урока:
Обучающие: познакомить уч-ся с историей открытия фосфора, его аллотропными модификациями и химическими свойствами, рассмотреть соединения фосфора, значение фосфора для здоровья человека.
Развивающие: развивать познавательный интерес к химии.
Воспитательные: воспитывать бережное отношение к своему здоровью.
Оборудование: красный фосфор, ложечка для сжигания, горелка, раствор фосфорной кислоты, нитрат серебра, чистые пробирки, презентация (Приложение 1), компьютер, медиапроектор, экран.
ХОД УРОКА
I. Организационный момент:
II. Актуализация знаний учащихся:
«Чудовище лежало перед нами…
Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я дотронулся до этой светящейся головы и, подняв руку, увидел, что мои пальцы тоже засветились в темноте.
– Фосфор, – сказал я.»
Итак, тема урока – «Фосфор и его соединения».
Прежде, чем мы перейдем к рассмотрению основных вопросов темы нашего урока, давайте сыграем в игру «Верите ли вы, что…»– химический знак фосфора Р (да)
– фосфор самый распространённый неметалл в земной коре (нет)
– фосфор имеет 5 электронов на внешнем электронном уровне (да)
– название «фосфор» переводится как «светоносный» (да)
– фосфор – необходимый элемент в питании растений (да)
– собака Баскервилей действительно была намазана фосфором (нет)
III. Новая тема
История открытия
Открытие фосфора приписывается гамбургскому алхимику Х. Брандту. В поисках «философского камня», якобы способного превратить неблагородные металлы в золото, Брандт занимался перегонкой сухого остатка от выпаривания мочи. В приёмнике оказалось вещество, испускавшее голубоватый свет. Так, совершенно случайно, в 1669 году был открыт белый фосфор – вещество, вызывавшее свечение. Поначалу у Брандта не было сомнения, что свечение без огня мог дать лишь искомый «философский камень». Однако вскоре он понял, что никакими другими чудесными свойствами его находка не обладает, и продал секрет другому алхимику. Тот, в свою очередь, перепродал его третьему и т. д. Конец «философскому бизнесу» положил английский химик Р.Бойль, который в 1680 году опубликовал в научном журнале более простую и доступную методику получения фосфора. Наименование элемента происходит от греческих слов «фос» – свет и «форос», – несущий. Название «фосфоры» приписывают всем веществам, светящимся в темноте после предварительного облучения, а само явление холодного свечения называют фосфоресценция.
Характеристика элемента
Порядковый номер – 15
Период – 3
Группа – V
Низшая СО – 3
Высшая СО + 5
Фосфор – простое вещество
а) Аллотропные модификации.
Фосфор – один из элементов, самых богатых аллотропными модификациями: белый, красный, чёрный, розовый, фиолетовый, алый и другие.
Свойства аллотропных модификаций фосфора
| Свойства | Белый | Красный | Черный |
| Кристаллическая решетка | Молекулы Р4 | Атомная
Слоистое строение | Металлическая |
| Физическое состояние | Воскообразное вещество | Порошок | Твердое вещество |
| Цвет | От белого до светло-желтого | От красного до фиолетового | Черно-серый |
| Запах | Чесночный | Не имеет | Не имеет |
| Растворимость в воде | Не растворяется | Не растворяется | Не растворяется |
| Растворимость в орг. растворителях | В спирте | Не растворим | Не растворим |
| Температура воспламенения | Самовоспламеняется при 50о С | 250о С | – |
| Свечение | В темноте светится | Не светится | – |
| Действие на организм | Очень ядовит! 0,1 г
вызывает сильные ожоги при попадании на кожу. | Не ядовит | Не ядовит |
б) Химические свойства
– Взаимодействует с металлами с образованием фосфидов: (окислитель)
2Р + 3Са = Са3Р2 (фосфид кальция) P + 3Na = Na3P (фосфид натрия)
– Горит в кислороде и на воздухе с образованием оксида фосфора (V): (восстановитель)
Д.О. 4Р + 5О2 = 2 Р2О5
Соединения фосфора
РН3 – фосфин. Бесцветный ядовитый газ с запахом гнилой рыбы, легко самовоспламеняется на воздухе. Образуется при гидролизе фосфидов.
Mg3P2 + 6H2O = 3Mg(OH)4 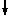 + 2PH3
+ 2PH3 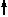
Р2О5 – оксид фосфора(V). Белый гигроскопичный порошок, хорошо растворяется в воде, является кислотным оксидом, образует несколько кислот.
Д.О. Р2О5 + 3Н2О (гор) = 2Н2РО4
Н3РО4 – ортофосфорная кислота. Твердое кристаллическое вещество белого или прозрачного цвета, не ядовита, кислота средней силы, хорошо растворим в воде. Реагирует со щелочами, основными оксидами, солями.
? Реагирует ли фосфорная кислота с металлами? Почему?
Д.О. Качественная реакция на фосфат-ион РО43– + 3Ag+ = Ag3PO4 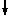
желтый
Соли.
| Соли | Название | Ион кислотного остатка | Пример | Растворимость |
| Средние соли | Фосфаты | РО43– | Са3(РО4)2 | Все нерастворимы, кроме солей К+ и Na+ |
| Кислые соли | Гидрофосфаты | НРО42– | СаНРО4 | Мало растворимы кроме солей К+ , Na+ и NH4+ |
| Дигидрофосфаты | Н2РО4– | Са(НРО4)2 | Все хорошо растворимы. |
Фосфор и здоровье человека
Содержание фосфора в организме человека (масса тела 70 кг) составляет 780 г. Суточная доза для взрослых 1 г.
Биологическая роль:
Входит в состав скелета в виде ортофосфата Са3(РO4)2.
Входит в состав зубов в виде гидроксиапатита и фторапатита Са3(РO4)2 • CaF2.
Соединения фосфора принимают участие в обмене энергии.
Необходим для нормальной мышечной и умственной деятельности. Академик Ферсман назвал его «элементом мысли».
Фосфор поступает в организм с пищей: рыбой, хлебом, молоком, сырами, мясом, бобовыми (горох, фасоль), овсяной, перловой, ячневой крупой. Для правильного питания очень важно его соотношение с кальцием. Оптимальным считается соотношение кальция и фосфора, равное 1 : 1,5.
Реакция организма на недостаток фосфора:
Развивается рахит, снижается умственная и мышечная деятельность.
Реакция организма на избыток фосфора:
Развивается мочекаменная болезнь.
Р4 и многие соединения фосфора высокотоксичны. Летальная доза Р4 равна 60 мг. Большую опасность представляют ожоги, возникающие при горении фосфора, из-за выделения большого количества тепла, при взаимодействии образующегося при горении Р2О5 с влагой кожи. Получившаяся фосфорная кислота Н3РО4 проникает вглубь соединительной ткани, что приводит к отеку из-за прилива внеклеточной жидкости.
Применение
1. Много красного фосфора идет на производство спичек. Головка спички содержит смесь бертолетовой соли, дихромата калия, стекла и клея. На спичечный коробок нанесена намазка из красного фосфора, сульфида сурьмы и клея. При трении головки спички о коробок спичка загорается:
6P + 5KClO3 = 3P2O5 + 5KCl + Q
2. Соединения фосфора входят в состав минеральных удобрений, необходимых растениям.
3. Хлорофос, дихлофос, карбофос – это инсектициды, фосфорорганические соединения, используемые для борьбы с насекомыми-вредителями.
IV. Закрепление
Даны следующие утверждения, выберите те, которые характеризуют
I вариант – красный фосфор, II вариант – белый фосфор
атомы фосфора связаны друг с другом в слои
молекула имеет форму тетраэдра
молекула имеет формулу Р4
молекула имеет формулу (Р4)n
атомная кристаллическая решетка
молекулярная кристаллическая решетка
воскообразное вещество бледно-желтого цвета
темно-малиновый порошок
черный порошок, жирный на ощупь
не растворяется ни в воде, ни в сероуглероде
не растворяется в воде, растворяется в сероуглероде
ядовитый
применяется в осветительных бомбах и снарядах
неядовитый
гигроскопичный
V. Домашнее задание
§ 28 упр. 1-3. Выполнить творческое задание: написать сказку, составить кроссворд по теме урока.
















