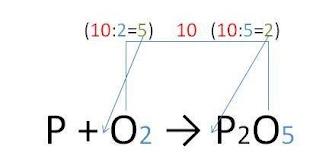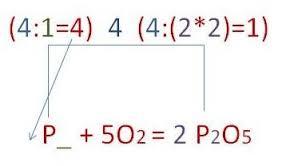|
Алгоритм составления формулы соединения
Алгоритм определения валентности

Алгоритм составления уравнений реакций

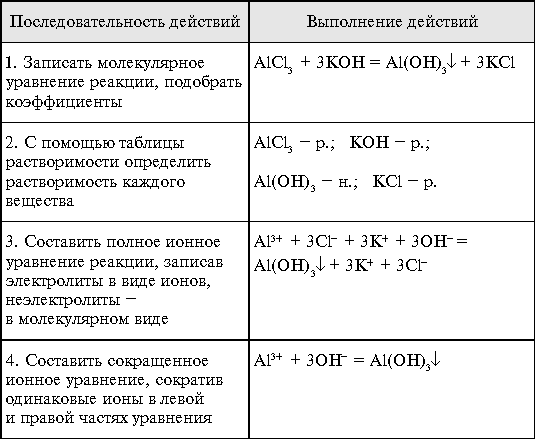
 Алгоритм составления ионных уравнений реакций Алгоритм составления ионных уравнений реакций

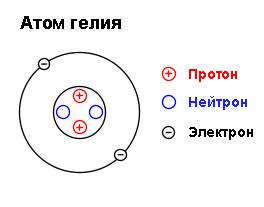
Строение атома

|
протоны
|
р
|
масса 1 заряд + 1
|
|
нейтроны
|
n
|
масса 1 заряд 0
|
|
электроны
|
|
масса 0 заряд -1
|

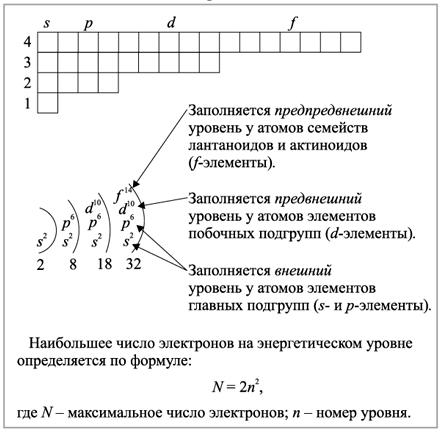
Распределение электронов в атоме
1s2s2p3s3p4s3d4p5s4d5p…
s-2é
p-6é
d-10é
f-14é
Химическая связь
|
|
Связываемые атомы
|
Механизм возникновения связи
|
Схема образования связи
|
Пример
|
|
Ковалентная
Неполярная
|
Атомы одинаковых неметаллов
ЭО1 =ЭО2
|
За счет общих электронных пар, которые не смешены
|
̤ ̤ ̤ ̤
:F̤∙ +∙F̤:→ :F̤:F̤:
̤ ̤ ̤ ̤
:О∙ +∙О:→ :О:О:
∙ ∙ ∙∙ ∙∙
|
H2, O2, N2, Cl2
|
|
Ковалентная
полярная
|
Атомы разных неметаллов
ЭО1 <ЭО2
|
За счет общих электронных пар, которые смешены к наиболее электроотрицательному атому
|
̤ ̤
Н∙ +∙F̤:→ Н:F̤:
|
H2 O,СO2, NН3, СCl4,Н Cl
|
|
Ионная
|
Атом металла и атом неметалла
ЭО1 < <ЭО2
|
Переход валентных электронов образование положительных и отрицательных ионов
|
̤ ̤ +
Nа∙ +∙F̤:→ Nа+ + |:F̤:|→ Nа+F̤-
|
NаF,СaS, NaBr, СаCl2, КCl
|
|
Металлическая
|
Атомы металлов
|
Отдача валентных электронов
|
М0 -nе→М+n
К0 -1е→К+1
|
Все металлы
|
|
Степени окисления
1.Элемент в простом веществе имеет нулевую степень окисления;
2.Все металлы имеют положжительную степень окисления;
3.Бор и кремний в соединениях имеют положительные степени окисления;
4.Водород имеет в соединениях степень окисления (+1).Исключая гидриды( соединения водорода с металлами главной подгруппы первой-второй групп, степень окисления -1, например Na+H- );
5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F-2 и в перекисях( Н2О2 - степень окисления кислорода (-1);
6.Фтор имеет степень окисления (-1)
Определить степени окисления в соединении K2Cr2O 7 .
У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)·7=(-14), у калия (+1)·2=(+2). Число положительных степеней окисления равно числу отрицательных. Следовательно (-14)+(+2)=(-12). Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит на один атом приходится (+12):2=(+6), записываем степени окисленя над элементами К+2Cr+62O-27
Окислительно- восстановительные реакции
 Мn +7- окислитель, S +4 - восстановитель Мn +7- окислитель, S +4 - восстановитель
|










 Мn +7- окислитель, S +4 - восстановитель
Мn +7- окислитель, S +4 - восстановитель