

- Водород — самый распространённый
элемент во Вселенной.
около 92 % всех атомов
- водород — основная составная
часть звёзд и межзвёздного газа.
- В условиях звёздных температур
водород существует в виде плазмы,
- в межзвёздном пространстве этот
элемент существует в виде отдельных
молекул, атомов и ионов .

Распространенность в природе
На долю водорода приходится
50 % массы Солнца и других звезд

В составе атмосферного воздуха присутствие водорода менее 0,0001 %

Земная кора (массовая доля)

В воде на долю водорода приходится 11%


Генри Кавендиш
Знаменитый английский физик и химик Г.Каведиш в 1766 исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы.

В 1779 г. Антуан Лавуазье получил водород при разложении воды, пропуская ее пары через раскаленную докрасна железную трубк у
Он установил, что «горючий воздух» входит в состав воды и может быть из нее получен.
В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество.
Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду».

- Русское название «водород» предложил химик М. Ф. Соловьев в 1824 году.
На рубеже 18 и 19 века было установлено,
что атом водорода очень легкий (по
сравнению с атомами других элементов),
и вес (масса) атома водорода был принят
за единицу.
.
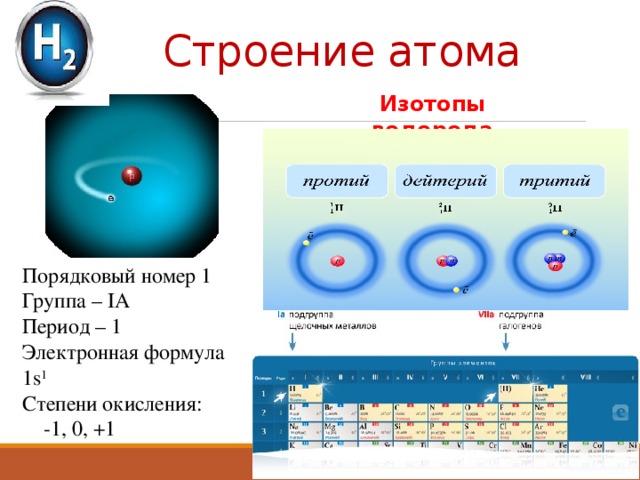
Строение атома
Изотопы водорода
Порядковый номер 1
Группа – IА
Период – 1
Электронная формула 1s 1
Степени окисления:
-1, 0, +1
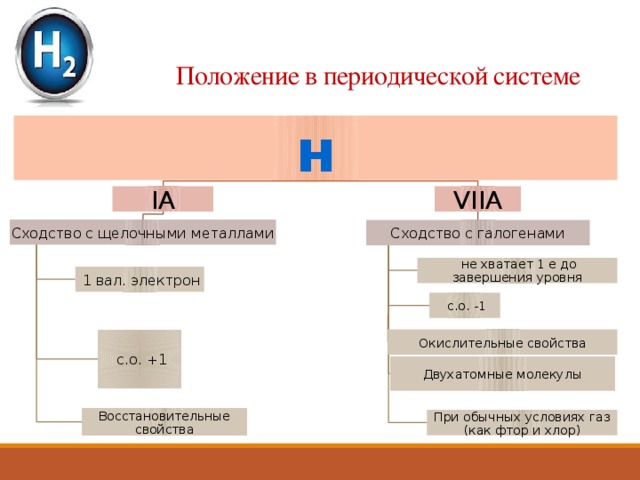
Положение в периодической системе
н
VIIА
IА
Сходство с щелочными металлами
Сходство с галогенами
не хватает 1 е до завершения уровня
1 вал. электрон
с.о. -1
Окислительные свойства
с.о. +1
Двухатомные молекулы
Восстановительные свойства
При обычных условиях газ (как фтор и хлор)
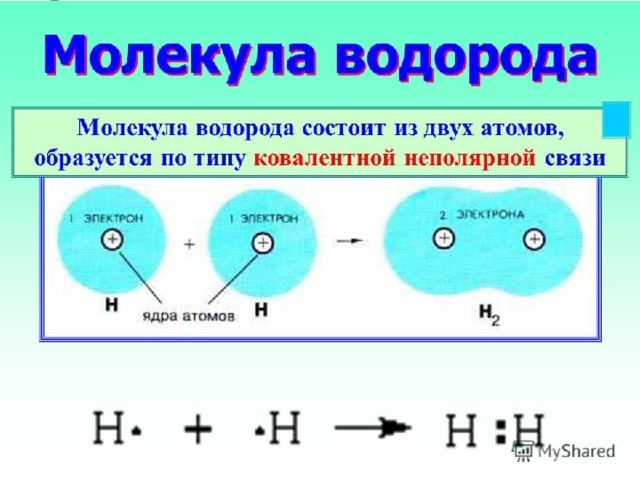
Строение молекулы


Опыт Пилатра де Розьера
Французский химик решил проверить, что
будет, если вдохнуть этот газ; до него никто
такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться проник ли газ в легкие.
Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако газ легких экспериментатора смешался с воздухом, и произошел сильный взрыв.
Розье впоследствии писал: «Я думал, что у меня вылетят все зубы вместе с корнями».

![Получение В промышленности – конверсией водяных паров с углем или метаном: С + H 2 O = CO + H 2 CH 4 + H 2 O = CO + 3H 2 II. В лаборатории : 1 ) действием разбавленных кислот (кроме HNO 3 ) на металлы: Zn + 2HCl = ZnCl 2 + H 2 2) взаимодействием кальция с водой: Ca + 2H 2 O = Ca(OH) 2 + H 2 3) разложением гидридов водой: NaH + H 2 O = NaOH + H 2 4) действием щелочей на Zn или Al: 2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2 5) электролизом воды: 2H 2 O = 2H 2 + O 2](https://fsd.multiurok.ru/html/2017/02/10/s_589e11c98062a/img16.jpg)
Получение
- В промышленности – конверсией водяных паров с углем или метаном:
С + H 2 O = CO + H 2
CH 4 + H 2 O = CO + 3H 2
II. В лаборатории :
1 ) действием разбавленных кислот (кроме HNO 3 ) на металлы: Zn + 2HCl = ZnCl 2 + H 2
2) взаимодействием кальция с водой:
Ca + 2H 2 O = Ca(OH) 2 + H 2
3) разложением гидридов водой:
NaH + H 2 O = NaOH + H 2
4) действием щелочей на Zn или Al:
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2
5) электролизом воды:
2H 2 O = 2H 2 + O 2
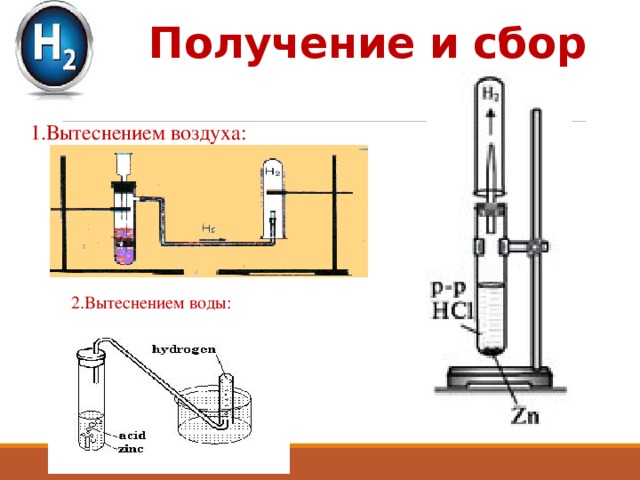
Получение и сбор
1.Вытеснением воздуха:
2.Вытеснением воды:

Химические свойства
1) Взаимодействие с металлами:
Ca + H 2 = CaH 2
CaH 2 + 2H 2 O = Ca(OH) 2 + 2H 2
2) Взаимодействие с неметаллами
H 2 + F 2 = 2HF
2H 2 + C = CH 4
2H 2 + O 2 = 2H 2 O
3) Восстановление металлов из оксидов:
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O

Применение
- Химическая промышленность : получение аммиака, метанола, мыла, пластмасс и др.

Применение
Пищевая промышленность :
а) производство маргарина
б) пищевая добавка Е949 (упаковочный газ)

Применение
- Топливо (ракетное, машинное)
- Военная промышленность (производство водородных бомб)
- Резка и сварка металлов























![Получение В промышленности – конверсией водяных паров с углем или метаном: С + H 2 O = CO + H 2 CH 4 + H 2 O = CO + 3H 2 II. В лаборатории : 1 ) действием разбавленных кислот (кроме HNO 3 ) на металлы: Zn + 2HCl = ZnCl 2 + H 2 2) взаимодействием кальция с водой: Ca + 2H 2 O = Ca(OH) 2 + H 2 3) разложением гидридов водой: NaH + H 2 O = NaOH + H 2 4) действием щелочей на Zn или Al: 2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2 5) электролизом воды: 2H 2 O = 2H 2 + O 2](https://fsd.multiurok.ru/html/2017/02/10/s_589e11c98062a/img16.jpg)















