Сабақ №
Күні:
Сыныбы: 9-сынып.
Пәні: Химия.
Сабақтың тақырыбы: §20. Фосфор.
Сабақтың мақсаты:
1. Білімділік – Оқушыларға фосфор жайлы жан-жақты білім қалыптастыру;
2. Дамытушылық – Оқушылардың ойлау, есте сақтау қабілеттерін барынша жан-жақты дамыту;
3. Тәрбиелік – Оқушыларды әдептілікке, адалдыққа тәрбиелеу.
Сабақтың түрі: Аралас сабақ: жаңа материалды игеру сабағы.
Сабақтың өтілу әдісі: Сұрақ-жауап, түсінік айту түрінде.
Сабақта қолданылған технология: Сатылай кешенді талдау.
Қажетті көрнекіліктер: Оқулық және ақ және қызыл фосфордың негізгі қасиеттері көрсетілген кесте.
Пәнаралық байланыс:
| Физикамен | Фосфорға физикалық түрде сипаттама беру |
| Өнеркәсіппен | Фосфордың қолданылуы |
Күтілетін нәтиже: Оқушылар фосфор жайлы толықтай дағды қалыптастырады.
Сабақтың барысы:
І) Ұйымдастыру кезеңі: а) сынып оқушыларын түгелдеу;
ә) оқушыларды сабақ мәзіріне дайындау;
б) сынып тазалығына назар аудару.
ІІ) Үй жұмысын тексеру кезеңі: §19-ды сұраймын және әр түрлі сұрақтар қоямын.
ІІІ) Үй жұмысын қорытындылау кезеңі: Тақырып бойынша жалпылама сұрақтар легі қойылады.
ІV) Жаңа сабақты түсіндіру кезеңі: Д.И.Менделеев жасаған химиялық элементтердің периодтық жүйесінде фосфор ІІІ периодта, V топтың негізгі топшасында орналасқан. Салыстырмалы атомдық массасы–31, реттік нөмірі–15.
Атом құрылысы. Фосфордың соңғы энергетикалық қабатында бес электрон бар, оның үшеуі жұптаспаған: +15Р )2е- )8е- )5е-
Электрондық формуласы: 1s22s22р63s23р3
*
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
Графиктік формуласы: 1s 2s 2р 3s
3р
Фосфор қосылыстарында -3, +3, +5 тотығу дәрежесін көрсетеді. Фосфорды 1669 жылы неміс химигі Х.Бранд ашқан.
Табиғатта кездесуі. Табиғатта фосфор тау жыныстары мен минералдарда қосылыс түрінде кездеседі. Қазақстанда Жамбыл облысындағы Қаратау маңында фосфорит кенінің мол қоры бар екені 1935 жылдан белгілі. Қазір Қаратау бассейні негізінде «Жаңатас байыту комбинаты» жұмыс істейді. Ақтөбе облысында фосфорит кен орнын (Шилісай, т.б) игеру жоспарланып отыр. Фосфорды өңдейтін заводтар Таразда, Шымкентте бар. Фосфор өсімдіктердің дәнінде, жануарлардың сүтінде, қанда, ми мен жүйке ұлпаларында кездеседі. Барлық сүтқоректілердің сүйегі құрамында фосфор Са3(РО4)2 немесе 3Са3(РО4)2*СаСО3*Н2О түрінде болады. Осындай фосфаттар сүтқоректілер қаңқасына беріктік қасиет береді.
Алынуы. 2Са3(РО4)2 + 6SiО2 + 10С = Р4 + 6СаSiО3 + 10СО↑
Физикалық қасиеттері. Фосфор элементі жай зат ретінде бірнеше аллотропиялық түр өзгерісін түзеді. Оның маңыздылары – ақ және қызыл фосфор, ал қара фосфор аз кездеседі. Ақ фосфор – түссіз және өте улы зат. Фосфор буын конденсациялау арқылы алады. Суда ерімейді, бірақ күкіртті көміртекте жақсы ериді. Ұзақ және әлсіз қыздырғанда ақ фосфор қызыл фосфорға айналады.
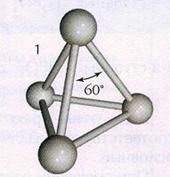
Қызыл фосфор – қызыл-қоңыр түсті ұнтақ зат, улы емес. Суда және күкіртті көміртекте ерімейді. Қызыл фосфордың бір-бірінен түрі, түсі (алқызыл түстен күлгінге дейін) және басқа қасиеттері арқылы бөлінетін бірнеше аллотропиялық түр өзгерістерінің қоспасы екендігі анықталған. Қызыл фосфордың қасиеттері көбінесе оның алыну жағдайына байланысты.
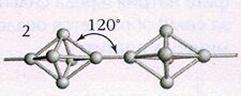
Қара фосфор – сыртқы түрі графитке ұқсайды, қолмен ұстағанда майлы, жартылай өткізгіштік қасиеті бар. Ақ фосфорды жоғарғы қысымда (2000С және 1200МПа) ұзақ қыздырғанда алынады.

Төмендегі кестеде ақ және қызыл фосфордың қасиеттері салыстырмалы түрде берілген.
6-кесте
Ақ және қызыл фосфордың негізгі қасиеттері
| Ақ фосфор | Қызыл фосфор |
| 1. Ақ түсті кристалл зат, тығыздығы 1,83 г/см3. 2. Қараңғыда жарқырайды. 3. Кәдімгі жағдайда 30-400С температурада ауадағы оттекпен тотығады. 4. От алғыш қауіптілігне байланысты су астында сақтайды. 5. Суда ерімейді, күкірткөміртекте ериді. 6. Өте қауіпті, улы! 7. 440С-та балқиды, 2800С-та қайнайды. | 1. Аморфты зат, кристалды емес, тығыздығы 2,20 г/см3. 2. Қараңғыда жарқырамайды. 3. Ауадағы оттекпен 2600С-та тотығады.
4. Отқа қауіпті емес. қыздырғанда оталады. 5. Суда да, күкірткөміртекте де ерімейді. 6. Улы емес. 7. 4000С-та балқиды. |
Химиялық қасиеттері. 1. Фосфор оттекте жанып пентаоксид түзеді:
4Р + 5О2 = 2Р2О5
2. Реакция жағдайына байланысты фосфор хлормен (700С) әрекеттесіп, фосфор трихлоридін РСl3 және 3000С-та фосфор пентахлоридін РСl5 түзеді:
а) 2Р + 3Сl2 = 2РСl3
ә) 2Р + 5Сl2 = 2РСl5
3. Фосфор сутекпен әрекеттесіп, фосфин РН3 түзеді:
2Р + 3Н2 = 2РН3
Фосфин РН3 – түссіз, ерекше иісі бар, өте улы зат. Аммиакқа қарағанда негіздік қасиеті әлсіз.
4. Шырпының басына жанғыш заттар – күкірт пен бертолле тұзының қоспасы жағылады. Қораптың жақтауына қызыл фосфор мен шыны ұнтағы желіммен отырғызылады. Шырпының басын қорапқа үйкегенде қызылфосфор бертолле тұзынан от алып тез тұтанады. Реакция теңдеуі:
+5 0 +5
5КСlО3 + 6Р = 5КСl- + 3Р2О5
5. Фосфор металдармен фосфидтер түзе әрекеттеседі:
0 0 +2 -3
3Са + 2Р = Са3Р2 кальций фосфиді
0 0 +2 -3
3Zn + 2Р = Zn3Р2 мырыш фосфиді
Мырыш фосфиді – зиянкес кемірушілермен күресуде қолданылатын препарат.
Қолданылуы. Қызыл фосфор сіріңке өндірісінде, пиротехникада және фосфор қышқылын алуға пайдаланылады. Ақ фосфор жанғанда будақ-будақ қалың қабатты ақ түтін (фосфор ангидриді) түзіледі, сондықтан оны «түтін шымылдығын» жасау үшін снаряд, бомбаларға салады.
V) Жаңа сабақты бекіту кезеңі: Жаңа сабақты бекіту мақсатында оқушыларға төмендегідей сұрақтар легін қоямын:
1. Фосфордың периодтық жүйедегі орнына сәйкес сипаттама беріңдер.
2. Фосфордың электрондық құрылымын жазыңдар. Фосфордың қандай тотығу дәрежесін білесіңдер?
3. Азот пен фосфордың атом құрылысын салыстыра отырып, ұқсастығы мен айырмашылығын айтып беріңдер.
4. Фосфордың табиғатта таралуын айтыңдар.
5. Қазақстанда қандай фосфорит кен орындары белгілі?
6. Фосфордың аллотропиялық модификациясы жайлы айтып беріңдер.
VІ) Сергіту сәті кезеңі: Осы кезде оқушыларды екі қатарға бөлемін және әр қатарға тиісті тапсырмаларын беремін.
1-қатар: Ақ фосфордың артықшылығы мен химиялық қасиеттері;
2-қатар: Қызыл фосфордың артықшылығы мен химиялық қасиеттері.
VІІ) Сабақты қорытындылау кезеңі: Сабақты қорыту барысында оқушыларға тақырып соңындағы 7 жаттығуды орындауды тапсырамын.
VІІІ) Үй тапсырмасын беру кезеңі: §20. Фосфор тақырыбын оқу, 8-жаттығуды орындау.
ІХ) Бағалау саясаты: Сабақ барысында белсенділік танытқан оқушыларды білім деңгейлеріне қарай әділ бағалаймын.




















