Просмотр содержимого документа
«" Генетическая связь между классами неорганических соединений"»

Апрель 2021
Генетическая связь между классами неорганических веществ.
ХИМИЯ – 8
Учитель химии МБОУ «Средняя общеобразовательная
Школа № 1» Хузина Э.М.

Цель урока
- Повторить и обобщить изученный материал:
- о классификации неорганических веществ;
- свойствах кислот, оснований, оксидов и солей .
- Сформировать понятие «генетический ряд», познакомить с генетическими рядами металлов и неметаллов и их видами.
- Формировать умение составлять генетические ряды металлов и неметаллов и записывать соответствующие им уравнения химических реакций.
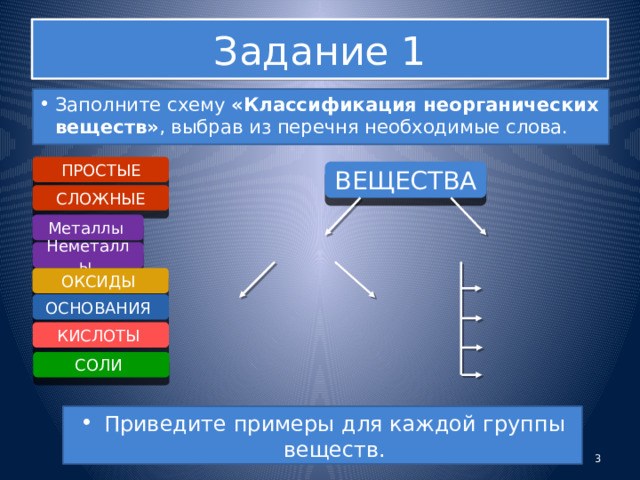
Задание 1
- Заполните схему «Классификация неорганических веществ» , выбрав из перечня необходимые слова.
ПРОСТЫЕ
ВЕЩЕСТВА
СЛОЖНЫЕ
Металлы
Неметаллы
ОКСИДЫ
ОСНОВАНИЯ
КИСЛОТЫ
СОЛИ
- Приведите примеры для каждой группы веществ.

Задание 2
- Горение фосфора в кислороде
2. Растворение оксида фосфора (V) в воде
Запишите уравнения химических реакций, показанных в опытах.
4Р + 5О 2 = 2Р 2 О 5
Р 2 О 5 + 3Н 2 О = 2Н 3 РО 4

- Последовательность превращений в этих опытах можно выразить схемой:
Р → Р 2 О 5 → Н 3 РО 4
- Что общего между веществами в этом ряду?
- В состав всех веществ в этом ряду входит элемент фосфор.

Задание 3
оксида кальция с водой
Запишите уравнения химических реакций, показанных в опытах.
2Са + О 2 = 2СаО
СаО + Н 2 О = Са(ОН) 2

- Последовательность превращений в этих опытах можно выразить схемой:
Са → СаО → Са(ОН) 2
- Что общего между веществами в этом ряду?
- В состав всех веществ в этом ряду входит элемент кальций.

- Таким образом мы получили две цепочки превращений:
Р → Р 2 О 5 → Н 3 РО 4
Са 3 (РО 4 ) 2
Са → СаО → Са(ОН) 2
- А возможна ли реакция между Н 3 РО 4 и Са(ОН) 2 ?
Запишем уравнение реакции:
2Н 3 РО 4 + 3Са(ОН) 2 = Са 3 (РО 4 ) 2 ↓ + 6Н 2 О

- Выделим общие признаки в записанных нами рядах:
- Все вещества одного ряда образованы одним химическим элементом.
- Вещества, образованные одним и тем же элементом, принадлежат к различным классам неорганических веществ.
- Вещества, образующие ряд одного элемента, связаны взаимопревращениями .
- Такие ряды получили название « генетические ».

Генетические ряды
Генетический ряд - это ряд веществ представителей разных классов , являющихся соединениями одного химического элемента , связанных взаимопревращениями и отражающих общность происхождения этих веществ.
Генетические ряды
металлов
неметаллов
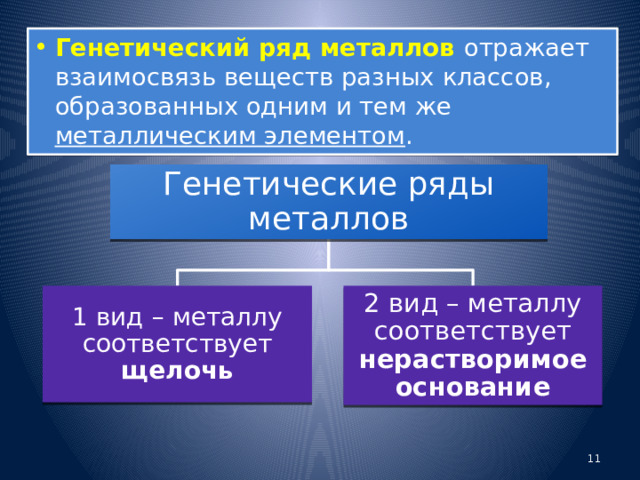
- Генетический ряд металлов отражает взаимосвязь веществ разных классов, образованных одним и тем же металлическим элементом .
Генетические ряды металлов
1 вид – металлу соответствует щелочь
2 вид – металлу соответствует нерастворимое основание

Генетические ряды металлов
- 1 вид – генетический ряд металлов , которым соответствует щелочь:
металл → основный оксид → щелочь → соль
Пример:
Ba → BaO → Ba(OH) 2 → BaCl 2
- 2Ba + O 2 = 2BaO
- BaO + H 2 O = Ba(OH) 2
- Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O

Генетические ряды металлов
- 2 вид - генетический ряд металлов, которым соответствует нерастворимое основание :
металл → основной оксид → соль → основание (Н) → основной оксид → металл
Пример: генетический ряд цинка
Zn → ZnO → ZnCl 2 → Zn(OH) 2 → ZnO → Zn
Задание: напишите соответствующие уравнения реакций.

- Генетический ряд неметаллов отражает взаимосвязь веществ разных классов, образованных одним и тем же неметаллическим элементом .
Генетические ряды неметаллов
1 вид – неметаллу соответствует растворимая кислота
2 вид – неметаллу соответствует нерастворимая кислота

Генетические ряды неметаллов
- 1 вид – генетический ряд неметаллов , которым соответствует растворимая кислота:
неметалл → кислотный оксид → кислота → соль.
Пример:
S → SO 2 → H 2 SO 3 → Na 2 SO 3
- S + O 2 = SO 2
- SO 2 + H 2 O = H 2 SO 3
- H 2 SO 3 + 2NaOH = Na 2 SO 3 + 2H 2 O

Генетические ряды неметаллов
- 2 вид - генетический ряд металлов, которым соответствует нерастворимая кислота :
неметалл → кислотный оксид → соль → кислота (Н) → кислотный оксид
- Из изученных нами кислот нерастворимой является только кремниевая кислота , поэтому рассмотрим в качестве примера генетический ряд кремния:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2
Задание: напишите соответствующие уравнения реакций.
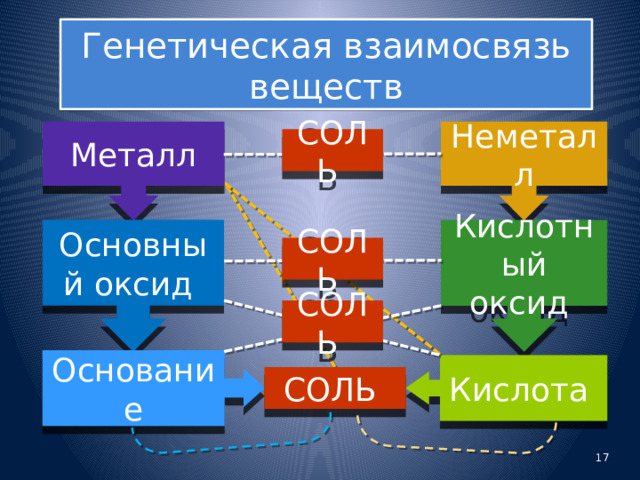
Генетическая взаимосвязь веществ
Неметалл
Металл
СОЛЬ
Основный оксид
Кислотный оксид
СОЛЬ
СОЛЬ
Основание
Кислота
СОЛЬ

- Где можно применить?
- Более сложные вещества могут быть получены из простых, минуя одну или две стадии в приведенных схемах, например, металл, взаимодействуя с кислотой, дает соль.
- Возможно образование не только более сложных веществ из менее сложных, но и наоборот.
- Различные способы получения оксидов, оснований, солей, кислот широко используют как в химических лабораториях, так и в химической промышленности.
- Производство кислот (серной, соляной, азотной, фосфорной), солей (минеральных удобрений — аммиачной и калийной селитры, суперфосфата, аммофоса), оксидов (например, негашеной извести СаО) и многих других неорганических соединений имеет важное значение для деятельности человека.
- Выбирая наиболее рациональные способы получения какого-либо вещества, обычно используют сырье, встречающееся в природе в достаточно большом количестве, или выпускаемое промышленностью.
Известняк

Экспериментальная задача
- Составьте генетический ряд по предложенному эксперименту и напишите соответствующие химические уравнения.
- Прокалить медную проволоку, удерживая ее тигельными щипцами, в верхней части пламени спиртовки (1–2мин).
- Удалить черный налет с проволоки и поместить его в пробирку. Прилить в пробирку 1-2 мл раствора соляной кислоты. Для ускорения реакции можно слегка нагреть ее содержимое. Что будет наблюдаться?
- Осторожно погрузить в пробирку с раствором железный гвоздь. Через 2–3 мин извлечь гвоздь из раствора. Что будет наблюдаться?

Домашнее задание:

Источники:
ЛИТЕРАТУРА
ВИДЕО-ОПЫТЫ
Г.Е.Рудзитис, Ф.Г. Фельдман
Химия, 8 класс : учеб. для общеобразоват. учреждений – 6-е изд., – М.: Просвещение, 2018г.
- https://www.youtube.com/watch?v=hsQCMg26-r0 - Взаимодействие оксида фосфора V с водой.
- https://www.youtube.com/watch?v=ITVcUT6renQ - Горение фосфора в кислороде.
- https://www.youtube.com/watch?v=sk9II9jG_vA – горение кальция на воздухе (обработано).
- https:// www.youtube.com/watch?v=enOR6DKQMn4 – Взаимодействие оксида кальция с водой.
- https:// www.youtube.com/watch?v=M4s0Ni392cs – CuO + HCl (фото).
- https:// www.youtube.com/watch?v=zxkOWCvXpdc – бородатый гвоздь (фото).






































