САБАҚТЫҢ ЖОСПАРЫ
ПЛАН УРОКА
Сабақтың тақырыб:
Тема урока: В мире железа
Сабақтың түрі: Сабақтың тақырыбы темір әлемі.
Тип урока:комбинированный (на основе интеграции курсов химии и физики).
Сабақтың мақсаттары:
Цели урока:
Білімділік:
Учебная:Повторить общую характеристику элемента железа, Изучить основные физические, химические свойства. Ознакомить с месторождениями железа и историей получения. Показать важную роль железа в жизни человечества.
Дамытушылық:
Развивающая: Развивать самостоятельность обучающихся, умение обобщать, находить необходимую информацию, используя учебник и дополнительную литературу, анализировать, делать выводы, устанавливать межпредметные связи с другими науками, создавать условия для развития познавательного интереса к предмету. Формировать навыки обращения с химическим оборудованием, реактивами и физическими приборами.
Тәрбиелік:
Воспитательная:
Воспитывать культуру общения обучающихся при работе в группах, дисциплинированность, четкость и организованность в работе. Формировать бережное отношение к своему здоровью.
Өткізу формасы:
Форма проведения: урок-конференция
Сабақтың әдістері:
Методы урока: словесный (рассказ), ИКТ; элементы проблемного обучения; наглядно-демонстрационный (получение информации через ТСО), метод развития самостоятельности и активности обучающихся (опережающее домашнее задание).
Пәнаралық байланысы:
Межпредметная связь:биология, география, история, литература.
Материалдық-техникалық жабдықталуы:
Материально-техническое оснащение:ПК, проектор, экран, колонки, периодическая система химических элементов Д.И.Менделеева, таблички с названием экспертов, презентация к уроку «В мире железа», видеоролик «Железо и его соединения», видеоролик «Железо - польза для здоровья, дефицит и избыток, продукты, богатые железом», видеоролик «Железо - жизненно важный металл для нашего организма» видеоролик «Наше достояние. Соколовско – Сарбайский горно-обогатительный комбинат», презентация «Как мастера – металлурги из руды варили железо», презентация «Как мастера- металлурги ковали железо», презентация «Как мастера- металлурги делали древесный уголь», видеофильм «Железо самый полезный металл на Земле», презентация «Сказка про железо», презентация «Физические свойства железа», презентация «Робинзон Крузо» и «Таинственный остров», видеофильм «Опыты с магнитом», презентация «Железорудные месторождения в РК».
Әдістемелік және оқыту әдебиеті
Методическая и учебная литература:Химия: Учебник для 10 классов естественно - математического направления общеобразовательных школ/ Нурахметов Н.Н., Бекишев К.Б., Заграничная Н.А.-Алматы «Мектеп», 2014г;
Физика:Учебник для 10 классов естественно - математического направления общеобразовательных школ/ Б.Кронгарт, В.Кем, Н.Койшыбаев-Алматы «Мектеп», 2014г
САБАҚТЫҢ БАРЫСЫ
ХОД УРОКА
| т/б № п/п | Сабақтың кезеңдері Этапы урока |
Средства | Уақыт (время), мин |
|
| Ұйымдастыру 1. Организационный | 5 |
| 1.1
| Проверка внешнего вида и подготовленностиобучающихся к уроку. Списочный состав групп экспертов: Преподаватель: сегодня у нас не обычный урок, а урок-конференция, на которую приглашены специалисты: Литературные критики (Афанасьева Ксения, Объедкова Анна, Алексеева Марина) Историки (Денисенко Вадим, Иванова Алена, Бичурин Константин, Бояшев Даурен) Эксперты-физики (Паксютов Дмитрий, Клыбанская Александра, Римашевская Дарья) Эксперты- химики (Луханина Мария, Мицул Илья, Кальков Дмитрий, Зыбалев Т.) Эксперты-биологи (Бухарбаева Арина, Гончаров Егор, Мамонов Г.) Эксперты-геологи (Бондарчук Данил, Энгельгарт Никита) Представители открытого акционерного общества «Соколовско-Сарыбайского» горно-обогатительного производственного объединения (Володченко Виктор, Хальзов Никита) Оценивание будет проводиться после каждого выступления специалистов-экспертов, итоги будут подводить Жаукенов Габит и Дунаев Эммануил. За компьютерное оснащение конференции ответственный Раскатов Сергей. |
Журнал
Таблички с надписями экспертов
| 5 |
|
| Жаңа материалды меңгеруге дайындық 2. Подготовка к изучению нового материала | 2 |
|
| Ознакомление с темой, целями урока,регламентом выступления групп специалистов и с правилами оценивания выступления каждой группы специалистов. Преподаватель: Ребята, сегодня мы с вами ознакомимся с самым важным для человека химическим элементом, то есть мы побываем в мире железа. Эпиграф к уроку. «Железо не только основа всего мира, самый главный металл окружающей нас природы. Оно основа культуры и промышленности, оно орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой такой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества» | Презентация «В мире железа» Слайд №1
Слайд №2 | 2 |
|
| 3. Шығармашылық қызметі, топтық жұмыс 3.Творческая деятельность, групповая работа |
|
| 3.1 | Преподаватель: Первое слово предоставляется литературным критикам. Выступление литературных критиков
| Приложение №1 Презентация«Робинзон Крузо» и «Таинственный остров» | 5 |
| 3.2 | Преподаватель: Как видим, без железа не может обойтись даже приключенческая литература. Чрезвычайно важное место занимает этот металл в жизни человека. А почему? Я думаю, станет нам всем понятно благодаря этой конференции. Слово мы предоставим историку, который откроет нам историю добычи и применения железа нашими предками.
Выступление историков
| Приложение №2 Презентация «Как мастера–металлурги из руды варили железо» Презентация «Как мастера- металлурги ковали железо» Презентация «Как мастера- металлурги делали древесный уголь» Видеофильм «Железо самый полезный металл на Земле» | 12 |
| 3.3 | Преподаватель: Предоставляем слово физикам-экспертам Выступление экспертов-физиков
| Приложение №3 Презентация «Физические свойства железа» Видеофильм «Опыты с магнитом» | 10 |
| 3.4 | Преподаватель: Слово предоставляется химикам – экспертам Выступление экспертов- химиков
| Приложение №4 Презентация «Железо» Видеофильм «Железо и его соединения» | 11 |
|
| Второй урок |
|
|
| 3.5 | Преподаватель: Медики часто говорят о железосодержащих лекарственных препаратах. Так важно ли железо для организма человека? Какова его биологическая роль? Выступление экспертов-биологов
| Приложение №5 Видеофильм «Железо-жизненно важный элемент для нашего организма» Презентация «Железо, его избыток в организме» | 10 |
| 3.6 | Преподаватель: Слово предоставляется геологам. Выступление экспертов-геологов
| Приложение № 6 Презентация «Железорудные месторождения в РК» | 10 |
| 3.7 | Преподаватель: Следующее выступление представителей открытого акционерного общества «Соколовско-Сарбайского» горно-обогатительного производственного объединения
| Приложение №7 Видеофильм «Соколовско – Сарбайский горно -обогатительный комбинат» | 11 |
| 3.8 | Преподаватель: Заключительное слово предоставляется литераторам. Выступление литераторов
| Презентация «Сказка про железо.» | 6 |
|
| 4. Сабақты қорытындылау 4. Подведение итогов урока | 2 |
| 7.1 | Итог урока: оценки и анализ ответов групп специалистов. |
| 2 |
|
| 5. Үй тапсырмасы 5. Домашнее задание | 1 |
| 8.1 | Приготовить сообщение работе горнодобывающего предприятия «ОРКЕН» и «Куржункульское» |
| 1
|
| 6. Рефлексия 6. Рефлексия | 5 |
| 9.1 | Рефлексия. Рефлексия. Обучающимся предлагается составить Синквейн 1. В первой строчке тема называется одним словом (обычно существительным). 2. Вторая строчка — это описание темы в двух словах (двумя прилагательными). 3. Третья строчка - это описание действия в рамках этой темы тремя словами. 4. Четвертая строка - это фраза из четырех слов, показывающая отношение к теме. 5. Последняя строка — это синоним из одного слова, который повторяет суть темы. |
| 5
|
Оқытушылар (преподаватели)___________________ (Мусина Г.Т.)
____________________ (Курилова С.В.)
Приложение №1Литературный критик. По роду своей деятельности я знаком со многими произведениями мировой литературы. Однажды меня заинтересовало внимание знаменитых произведений к одному химическому элементу, которое как казалось, мне раньше не имеет отношения к литературе.
Мне бы хотелось напомнить вам отрывки из этих хорошо известных вам произведений.
-Герою знаменитого романа Даниэля Дефо повезло. Корабль, с которого он спасся, сидел на мели совсем недалеко от острова. Робинзон сумел погрузить на плот все необходимое и благополучно переправился на остров. Ему повезло, еще раз цитирую роман: «После долгих поисков я нашел ящик нашего плотника, и это была для меня поистине драгоценная находка, который я не отдал бы тогда за целый корабль с золотом» … Что было в плотницком ящике? Обыкновенные железные инструменты: топор, пила, молоток, гвозди.
Через два столетия на другой необитаемый остров попали герои другого французского романа - пятеро американцев. Они сумели не только выжить на острове, но и создать себе более или менее нормальные условия жизни, что определенно не удалось бы если бы всеведущий инженер Сайрес Смит (заметим, что по, английски «смит» означает «кузнец») не сумел найти на таинственном острове железную руду и сделать железные инструменты. Иначе опять пришлось бы Жюлю Верну выручать своих героев с помощью знаменитого капитана Немо….
Приложение №2
Историк: Использование железа в древности
Человечество познакомилось с железом ещё в медном веке, когда люди того времени находили, по их мнению, тяжелые камни – метеориты. Метеоритное железо имело высокую твердость, из-за содержания никеля, а также поддавалось ковке, но все же было крайне редким, поэтому оружие их метеоритного железа зачастую доставалось только самым важным членам общества. Впоследствии в I тысячелетии до н.э. люди освоили искусство получения железа из руды, из-за того, что она встречалась гораздо чаще, чем медные или оловянные руды. К примеру, первые железные изделия получали прокаливанием болотной руды с углем. Позже для получения железа использовали магнетитовый песок или минерал гематит, который прокаливали с углем в печах. Но вот только в древности люди не могли достигнуть достаточно высокой температуры, при которой плавится железо и поэтому придавали форму железным изделиям с помощью ковки. После ковки люди научились делать более эффективные печи, в которых температура могла достигать 1400 С и можно было уже выплавить чугун. Однако, получившийся металл был очень хрупким и не поддавался ковке из-за высокого содержания углерода в сплаве. Спустя время путем пропускания через сплав потока воздуха удалось все же выжечь большую часть ненужного углерода и получить мягкое железо, которое уже можно было легко обработать, использовать во многих отраслях. К примеру, из такого железа построена Эйфелева башня в Париже. Позже в XX веке появились более совершенные способы получения железа и стали разных сортов, которых существует огромное количество. В земной коре по распространенности железо стоит на 2 месте после алюминия. И из-за того, что соединения трехвалентного железа имеют бурый цвет, реки вымывают железные минералы из почвы, окрашивая воду в такой цвет.
Вся наша Земля состоит из 32% железа, большая часть которого находится в ядре. Оно создает магнитное поле, защищающее нас от космических лучей солнца и жесткого радиационного фона, как, например, на Марсе. Красный цвет Марса из-за оксида железа III. Оксида железа III используется, как отличный красящий пигмент, а также для реакции термита, которую используют для сварки стальных рельсов.
Человек настолько симпатизирует железу, что в Брюсселе построили здание, которое внешне выглядит, как кристаллическая решетка железа. Внутри ест лифт. Проводятся экскурсии. А в каждом атоме есть комнаты, в которых находятся музейные экспонаты, описывающие мирное применение атомной энергии.
Приложение №3
Эксперт – физик.
Железо, как и все металлы обладает большой теплопроводностью, является хорошим проводником тепла.
Металлическая кристаллическая структура отличается наличием в узлах решетки положительно заряженных ионов металла. У атомов всех металлов валентные электроны, т.е. наиболее удаленные от ядра, слабо связаны с атомами. Электронные облака таких периферийных электронов перекрывают сразу много атомов в кристаллической решетке металла: это означает, что валентные электроны в кристаллической решетке металла не могут принадлежать одному и даже двум атомам, а обобществляются сразу многими атомами. Такие электроны практически могут беспрепятственно двигаться между атомами.
Таким образом, каждый атом в твердом металле теряет свои периферийные электроны и атомы превращаются в положительно заряженные ионы. Оторвавшиеся от них электроны движутся между ионами по всему объему кристалла и придают большую прочность металлу.
В первом приближении хаотическое движение свободных электронов в металле можно считать подобным движению молекул идеального газа. Поэтомусовокупность свободных электронов в металле иногда называют электронным газом и при расчетах применяют к нему формулы, выведенные для идеального газа. Существованием электронного газа в металлах объясняется как высокая теплопроводность, так и высокая электрическая проводимость всех металлов.
(Демонстрация опыта с железным и стеклянным стержнями.
Наблюдение: железный стержень нагревается быстрее, чем стеклянный.
Вывод: теплопроводность железа больше стекла.
сж= 460 Дж/кг 0С
сст.=840 Дж/кг 0С, где с- удельная теплоемкость вещества. (слайд)
Кристаллические решетки металлов бывают двух типов: кубическая (разновидности – гранецентрированная, объемноцентрированная) и гексагональная. Железо обладает кубической объемноцентрированной решеткой. В такой решетке частица заполняет 68 % объема. (слайд 5)
В природе железо встречается в твердом состоянии. В основном железо используется не в чистом виде, а в сплавах с другими химическими элементами. Для этого железо расплавляют.
Тпл= 1539 0 С;
λ = 2,7 105 Дж/кг, где λ - удельная теплота плавления.
Опыты
Представим физические опыты с применением предметов в состав которых входит элемент железо.

Что притягивает магнит? Ответ прост - это железо.
Нужно отметить, что ученые считают, будто весь мир вокруг нас намагничен. Магнитные свойства есть и у самых маленьких частичек – атомов, и у людей, а Земля и Солнце тоже магниты.
СИЛА МАГНИТА.
Существуют более сильные и слабые магниты. Взяли мы большой магнит и маленький и стали цеплять на них скрепки. От большого магнита выстроилась цепочка из трех больших скрепок, а от маленького – только две.
По количеству примагниченных скрепок делаем вывод, что сильнее оказался большой магнит.
Проводя этот простой опыт, сделали небольшое открытие – скрепки побывав в магнитном поле стали временными магнитами, то есть стали притягиваться друг к другу просто так без внешнего воздействия.

ДЕЙСТВИЕ МАГНИТА ЧЕРЕЗ РАЗНЫЕ МАТЕРИАЛЫ.
Теперь проверим способность магнита действовать через другие предметы.
Для начала, взяли лист бумаги, сверху положили скрепку, а снизу водили магнитом и давали команды скрепке. Удивительно, но скрепка безошибочно слушалась и двигалась в указанном направлении. Далее утолщили преграду, взяв книгу. Потом уже играли с гвоздями, водя магнитом под столом…
В пластиковую бутылку с водой мы набросали скрепок, гвоздей, пружинку и была поставлена задача вытащить эти мелочи из воды, не намочив рук.
Магнитная сила действует и сквозь бумагу, и пластик, стекло и воду, и через многие другие материалы.
Вывод, магнит может действовать через различные предметы.
ЛИНИИ МАГНИТНОГО ПОЛЯ.
Вокруг магнита создается магнитное поле, но его нельзя увидеть, и я его совсем не чувствую (хотя допускаю, что кто-то способен его увидеть).
С помощью ножовки или напильника приготовьте небольшое количество железных опилок. Насыпьте их на бумажку или тонкую картонку и поднесите под них сильный магнит. При передвижении бумажки над магнитом опилки начнут создавать разные узоры. Опилки стараются расположиться вдоль магнитных силовых линий. При передвижениях бумажки эти узоры меняются.
Таким образом, с помощью опилок можно как бы сделать видимым магнитное поле, точнее, его отдельные силовые линии.

КОМПАС
А что вы знаете о компасе? (это магнитная стрелка, насаженная на железный сердечник, стрелка компаса указывает на север)
Сделаем свои компасы, используя иголку, магнит и блюдце с водой.
Как сделать компас своими рукам.
1) Для начала провели магнитом вдоль иголки. Делать это следует в одном направлении.
2) В блюдце набрали холодную воду.
3) Попробовали положить иголку на воду. Получилось только у одного человечка, поэтому было решено упростить задачу. На воду вначале положили полоску бумажной салфетки, а уже сверху пристроили иголку. Через несколько минут салфетка утонула, а иголка осталась лежать на поверхности воды. Кстати, почему? Что ее удержало? (это - Поверхностное натяжение воды).
4) Иголка стала стрелкой нашего домашнего компаса, которая плавно повернулась, указав одним своим концом на север. Это мы сверили по настоящему компасу.

МАГНИТНЫЙ МАЯТНИК
На нитке висит маленький гвоздик, недалеко от него надо установить магнит. Как, не касаясь ни гвоздика, ни магнита, заставить гвоздик качаться подобно маятнику? Задача решается следующим образом: надо взять ножик и то помещать его между полюсом магнита и гвоздем, то убирать. Магнитная сила свободно проходит через все тела, кроме железа. Железо представляет собою магнитный экран. Таким образом, когда ножик помещается между полюсом магнита и гвоздем, он преграждает путь магнитным силовым линиям к гвоздю, и гвоздик висит вертикально. Когда убираем ножик, то тем самым даем возможность силовым линиям действовать на гвоздь. Гвоздик с большей или меньшей силой притягивается к магниту и отклоняется от вертикали. Рядом таких последовательных манипуляций удается довольно быстро привести гвоздик в колебательное движение.
"ПРИЛИПШИЙ" ВОЛЧОК
Сделай легонький волчок из кружка картона, насаженного на тонкую палочку. Нижний конец палочки заостри, а в верхний вбей булавку, да поглубже, так, чтобы только головка была видна. Пусти волчок вертеться на столе, а сверху поднеси к нему магнит. Ближе, еще ближе. Оп-ля! Волчок подпрыгнет, и булавочная головка пристанет к магниту. Но вот что удивительно: волчок не остановится. Он будет вращаться, «вися на голове»!
«ИСЧЕЗНОВЕНИЕ МАГНЕТИЗМА»
К сожалению, у магнита есть враг, который лишает его силы. Этот враг — высокая температура. Ведь как было бы хорошо заставить мощные электромагниты на заводах поднимать и переносить, например, раскаленные железные балки. Однако железо, нагретое до определенной температуры, теряет магнитные свойства, и даже самый мощный магнит его не притянет.
Опыт: Укрепите иголку, висящую на нитке, как и в предыдущем опыте, против сильного магнита. Только расстояние от конца иголки до магнита уменьшите до нескольких миллиметров. Иголка будет висеть горизонтально, удерживаемая с одной стороны ниткой, с другой стороны — притяжением магнита. Поднесите к концу иголки горящую спичку. Иголка, нагревшись, сразу упадет. Когда она остынет, ее вновь можно будет расположить в горизонтальном положении. Теперь попробуйте очень медленно подводить горящую спичку к концу иголки. Как только заметите, что иголка начинает опускаться, сразу убирайте спичку. Иголка, не успев сильно нагреться, вернется на свое место у магнита.
ИЛИ :Пожалуй, лучше всего взять не нитку, а кусочек нихромовой проволоки от спирали старой электроплитки. Такая проволока и не перегорает и не намагничивается. А чтобы не обжечься, сделайте петельку на одном из ее концов, проведите сквозь эту петельку булавку, которую и воткните в пробку. К другому концу проволоки прикрепите маленький гвоздик или булавку. В остальном опыт проводится так же, как было описано выше.
Приложение №4
Эксперт-Химик: Положение в периодической системе химических элементов и строение атома Железо- элемент 4 периода побочной подгруппы VIII Б группы, порядковый номер 26 (слайд увеличенное изображение Fe с табл.), в ядре атома содержится 2 6 протонов и 30 нейтронов. Атомная масса 56, число электронов равно 26.
Электронная формула: 26Fe 1s2 2s22p63s23p63d64s2
Графическая формула:
Валентные электроны 4s23d6
В химических реакциях может отдавать 2 или 3 электрона проявляя степени окисления +2 и +3.
Наиболее устойчивая степень окисления +3
Взаимодействие железа с концентрированными кислотами.
Приготовим две колбы с кусочками железа. Концентрированная азотная кислота бурно реагирует с железом. Продукты реакции - нитрат трехвалентного железа и бурый газ-оксид четырехвалентного азота. Крепкая серная кислота тоже реагирует с железом – выделяется сернистый газ, и в том и другом случае происходит окисление железа до трехвалентного состояния. Концентрированные и безводные кислоты не одно и то же. Безводная серная и азотная кислота пассивируют железо, не реагируют с ним.
Качественные реакции на железо (II).
Как определить в растворе ионы двухвалентного железа? Возьмем для опытов сульфат двухвалентного железа. Добавим красную кровяную соль – гексоцианоферрат калия. В присутствии ионов двухвалентного железа образуется темно-синий осадок – комплексная соль железа. Это доказательство присутствия ионов двухвалентного железа. Добавим щелочь в колбу с солью железа - образуется серо-зеленый осадок, значит в растворе ионы двухвалентного железа, образовавшийся осадок – гидроксид двухвалентного железа.
Качественные реакции на железо (III).
Ионы трехвалентного железа в растворе можно определить с помощью качественных реакций. Возьмем для опыта раствор хлорида трехвалентного железа. Первая качественная реакция со щелочью. Если в растворе есть ионы трехвалентного железа, образуется гидроксид трехвалентного железа. Основание нерастворимо в воде и бурого цвета. Вторая качественная реакция на ион трехвалентного железа с желтой кровяной солью. Желтая кровяная соль это гексоцианоферрат калия. Синий осадок берлинской лазури показывает на присутствие в исходном растворе ионов трехвалентного железа. И третья качественная реакция на ион трехвалентного железа реакция с радонитом калия. Вначале разбавляем испытуемый раствор, иначе не увидим ожидаемой окраски. В присутствии ионов трехвалентного железа образуется вещество красного цвета – это радонит трехвалентного железа. С помощью таких реакций можно обнаружить в растворе ионы трехвалентного железа.
Получение гидроксида железа(II) и взаимодействие его с кислотами.
Получим гидроксид двухвалентного железа. Для этого воспользуемся реакцией растворимой соли двухвалентного железа со щелочью. Соединим сульфат двухвалентного железа и гидроксид калия – образуется серозеленый осадок гидроксида двухвалентного железа. Как действует кислота на серо-зеленый осадок? Добавим в раствор соляной кислоты. Осадок гидроксида растворяется, образуется раствор хлорида двухвалентного железа. По цвету осадка можно различить соли двухвалентного железа и трехвалентного железа.
Получение гидроксида железа (III) и взаимодействие его с кислотами.
Получим гидроксид трехвалентного железа взаимодействием растворов хлорида трехвалентного железа и гидроксида калия. Это обычный способ получения нерастворимыхоснований - реакция обмена растворимой соли и щелочи. Выпадает бурый осадок – это гидроксид трехвалентного железа. Как гидроксид реагирует с кислотами? Добавим раствор соляной кислоты. Осадок гидроксида железа растворяется. Образуется желтый раствор хлорида трехвалентного железа. Реакции обмена с кислотами могут превращать нерастворимые основания в растворимые соли.
Роль кислорода в процессе коррозии железа.
Коррозия – это разрушение металлов под действием кислорода и воды. Попробуем установить зависимость степени коррозии железа от степени аэрации, то есть от доступа кислорода к поверхности металла. Опустим в пробирки железные гвозди и добавим воды. В первую пробирку до половины, во вторую и третью до верха. В третью пробирку нальем слой растительного масла. Сплошной слой масла блокирует поступление кислорода в толщу воды. Посмотрим, что произошло с гвоздями через некоторое время. Больше всего ржавчины на гвозде из первой пробирки. Этот гвоздь соприкасался и с водой и с воздухом. Доступ кислорода к поверхности металла был свободным. На гвозде из второй пробирки коррозии меньше, так как железо взаимодействовало только с небольшим количеством растворенного в воде кислорода. Гвоздь из третьей пробирки почти не поржавел. Кислород не мог пройти через слой растительного масла, а без кислорода коррозия не развивается.
Получение железа алюмотермией.
Сейчас мы получим железо из оксида при помощи порошка алюминия. Такой способ получения металла из руды называется алюмотермией. Сейчас мы готовим смесь порошкообразного алюминия и оксида железа, так называемый термит. На дне тигля алюминиевая фольга. Слегка утрамбуем термит и подготовим углубление для зажигательной смеси. Поместим зажигательную смесь в ямку. Используем магниевый фитиль, чтобы поджечь термит. Способом алюмотермией можно получить очень чистое, свободное от углерода, железо. Вы видите, как раскалился тигель, температура реакции превышает 3000 С. Внутри тигля расплавленное железо и шлаки. К наружной поверхности тигля прилипли песчинки, даже песок оплавился от высокой температуры. Вот содержимое тигля. Восстановленное металлическое железо притягивается магнитом.
Приложение №5
Эксперт-биолог. Француз Мери в X I X веке сделал сенсационное открытие – обнаружил железо в крови человека. Несведущие в медицине люди были поражены сообщением Мери, кто-то даже предложил чеканить медали из железа, выделенного из крови знаменитых людей для увековечиванияих памяти.
В истории медицины известен такой печальный случай. Один студент-химик решил подарить своей возлюбленной кольцо, сделанное из железа собственной крови, Выпуская время от времени кровь, он получал соединение, из которого химическим путем выделял железо. Юноша погиб от наступившего малокровия. Он так и не собрал нужного количества железа для изготовления кольца. Бедняга не знал, что общее содержание железа в крови взрослого человека невелико и составляет в среднем 3-4 грамма, чего хватает разве что на два крошечных сапожных гвоздика.
Железо занимает в природе особое место. При его участии формировались атмосфера и гидросфера Земли. Доказано, без атомов железа невозможно было бы само возникновение жизни, а человек не прожил бы и нескольких минут. Без еды можно прожить не больше недели, без воды 3-4 дня, без железа несколько минут.
Ядро планеты состоит из расплавленного железа, которое выполняет функцию мощнейшего магнита и формирует магнитный пояс Земли. Именно он защищает все живое от испепеляющей космической радиации, предохраняет озоновый слой Земли от разрушения по воздействием космических лучей. Металл, который пришел из космоса, чтобы создать, а после хранить и оберегать нашу планету. Ведь никакие другие небесные светила не сравнятся с замыслом Земли и её красотой.
Каждый из нас носит в себе около 5 г космического металла, которому мы обязаны самой возможностью жизни. Ведь основная роль железа в организме помогать нам дышать. За дыхание отвечает сложный белок крови- гемоглобин. Один из основателей науки о дыхании английский физиолог Джозеф Баркрофт назвал гемоглобин самым удивительным веществом в мире. Ведь он должен захватывать кислород из воздуха и переносить его в органы и ткани, к каждой клетке. Гемоглобин состоит из двух частей- крупной белковой молекулы-глобина, и встроенной в нее небелковой структуры гема, в сердцевине которого находится ион железа. Именно железо легко вступает в связь с кислородом и обеспечивает его доставку в нужное место. Соединение кислорода с железом окрашивает нашу кровь в красный цвет. Больше половины всех запасов железа в организме человека приходится на гемоглобин. Уровень гемоглобина в крови один из самых важный показателей состояния здоровья. При дефиците железа нарушается нормальное обеспечение организма кислородом. Клетке становится буквально нечем дышать и это сказывается на работе всех органов и систем, снижается иммунитет, организм одолевают патогенные бактерии и вирусы, у детей происходит задержка роста и умственного развития. Кроме того, последниеисследования ученыхпоказывают, при хронической железодефицитной анемии страдает интеллект.
Организм не способен справится с анемией сам по себе. Мы не можем вырабатывать железо и получаем его только с пищей. Согласно последним исследованиям железо является самым проблемным в получении микроэлементом, а железодефицитная анемия- самым распространенным видом недостатка питательных веществ в мире. Всемирная организация здравоохранения публикует следующие данные: «Нехваткой железа страдают около 30% всего населения Земли, 43% детей дошкольного возраста, 37% школьного возраста, половина всех женщин детородного возраста, каждая третья беременная женщина».
Анемия протекает безболезненно, поэтому многие не считают её серьёзным заболеванием. Однако, при нехватке железа органы испытывают большую нагрузку, больше изнашиваются и быстрее стареют. Как человеку заподозрить у себя дефицит железа? Как правило это человек, который испытывает слабость, усталость, утомляемость, сонливость, у него сухая кожа, у него заеды в уголках рта, волосы тусклые, ногти в полосочку, этот человек не переносит душных помещений, становится плохо в метро и автобусах. Затем могут появится отдышка и боли в сердце. Главная группа риска – это организм женщины. Как результат, с недостатком железа уходит привлекательность и красота. Нездоровый цвет кожи, бледность, утомляемость, неспособность организма бороться с лишним весом, раздражительность и плохое настроение. Анемия ускоряет наступление умственных расстройств в пожилом возрасте и это закономерно - ведь мозг годами страдает от кислородного голодания.
Чтобы избежать анемию необходимо восполнять ежедневные потери железа. И им, действительно, богаты фасоль, горох, гречневая крупа, гранаты, яблоки и ряд других продуктов. Для здоровья человеку необходимо железа в гораздо большем объеме, чем оно расходуется.
Избыточное накопление железа в организме – гемохроматоз может спровоцировать развитие сахарного диабета, цирроза печени, заболеваний сердца.
Основные симптомы избыточного потребления железа: диарея, тошнота, рвота, боли в животе, головная боль, выпадение волос, металлический привкус во рту, кожа приобретает оттенок ржавчины.
Рекомендуемая суточная норма: дети 1-3 года 7 мг, 4-8 лет 10 мг, 9-13 лет 8 мг, юноши 14-18 лет 11 мг, девушки 14-18 лет-15 мг, мужчины старше 19 лет 8 мг, женщины 19-50 лет 18 мг, женщины старше 51 года 8 мг. Беременные женщины 27 мг, кормящие женщины 9-10 мг.
Существует 2 типа железа, получаемого из пищевых источников:
Гемовое железо, которое содержится в пище животного происхождения.
Негемовое железо, которое человек получает из растительных источников.
Гемовое железо усваивается значительно лучше негемового.
Продукты, богатые витамином С облегчают усвоение железа.
Мешают усвоению железа: чай, кофе, алкоголь, молоко и его производные, отруби.
Содержание в продуктах от дневной нормы: яйцо 1,2 мг -9%, мясо кур 1,2 мг- 9%, куринные сердечки 6 мг -46%, тунец 1,4 мг-11%Э, крабы 2,5 мг- 19%, гречиха 2,2 мг-17%, курага 2,7 мг- 21%, говядина 3 мг- 23%, миндаль 3,7 мг-29%, мидии 3,9 мг-30%, осьминог 5,3 мг-41%, устрицы 5,8 мг-45%, белая фасоль 10,4 мг-80%, чечевица 6,5 мг – 50%, соя 15 мг – 115%, тыквенные семечки 8,8 мг – 68%, семечки подсолнуха 5,3 мг – 41%, кунжут 14,5 мг – 112%, печень 7-30мг – 54-230%.
Приложение №6
Эксперт- геолог.
Геолог знающий для нас
Найдёт в земле и нефть, и газ.
Укажет глубину буренья,
Объём всего месторожденья.
Геологической разведкой
Он минерал откроет редкий.
(О. Повещенко )
Геолог – Это специалист который ищет и исследует месторождения полезных ископаемых
Геологи ходят в научные экспедиции и ищут залежи полезных ископаемых, которые находятся глубоко под землей. Полезными они называются потому, что приносят пользу людям.
С молоточком по горам
Он проходит тут и там
И уверен: «Я найду
Здесь железную руду!»
(Е. Санин)
В находке геолога много железа,
И тем она людям, конечно, полезна.
Среди ископаемых ценной всегда
Считалась добытая в шахте… (руда)
Профессия геолог. Кто такой геолог?
У многих давно сложился стереотипный образ геолога: бородатый мужчина в толстом свитере и с огромным рюкзаком днем собирает камни, а ночью сидит у костра возле своей палатки.
Сегодня, как и прежде, профессия геолог пользуется высоким спросом. Работа специалиста довольно разнообразна, однако в большинстве случаев она сводиться к поиску и разработке месторождений полезных ископаемых.
Канули в лету многокилометровые походы по заснеженной тайге, тонны документации и безмолвная тишина природы. Сегодня в арсенале специалистов современное дорогое оборудование, которое значительно облегчает геологические работы. Однако каким бы передовым оборудованием не владел геолог, успех в поиске разведке месторождений всецело зависит от грамотности и опыта специалиста.
Что делает и чем занимается геолог?
На просторах бывшего Союза мест, где не ступала нога человека, практически не осталось. Поиск нового месторождения начинается с анализа результатов прошедших экспедиций. На основе полученных данных выделяется перспективная площадь, после чего подается заявление на получение лицензии для проведения работ. Аналитическая составляющая – это важнейший этап геологии. Начинать работы на одних лишь предположениях слишком рискованно и дорого.
Прибыв на место, команда начинает разведку. На первом этапе используются самые простые инструменты – компас и молоток, для более детального изучения применяется бур, прокладываются траншеи и канавы. В современной геологии, безусловно, используется компьютер. Он необходим для дешифровки спутниковых данных касательно ландшафта и типа местности, занесения информации в базы данных. Кроме этого, специально разработанные программы позволяют быстрее понять перспективы месторождения.
Исследовательская команда состоит из главного геолога, участковых геологов и исполнителей. В зависимости от целей экспедиции, в состав могут входить эксперты по отбору проб полезных ископаемых.
Профессия геолог не предполагает нормированного графика: все упирается в погодные условия, сроки и амбиции специалистов. Подавляющее большинство геологов работают в компаниях, выполняющих на заказ исследование территории.
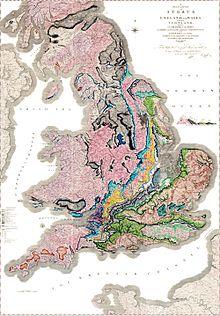
Так выглядела - первая геологическая карта У. Смитта 1815г.
Геолог может делать следующее:
Проводить исследования почвы на наличие полезных ископаемых.
Участвовать в экспедициях, нацеленных на изучение геосферы в различных уголках земли.
Составлять топографические карты и планы участков.
Проводить лабораторный анализ образцов минералов.
Помогать в строительстве шахт, нефтедобывающих скважин, карьеров и так далее.
Проводить оценочные исследования экономической выгоды ископаемых на конкретном участке.
Если месторождение железных руд признано целесообразным для разработки, составляется проект на его отработку и ведутся добычные работы.
Казахстан обладает разнообразными полезными ископаемыми. Из 105 элементов таблицы Менделеева в недрах Казахстана выявлено 99, разведаны запасы по 70, вовлечено в производство более 60 элементов.
Железо
Казахстан занимает третье место после России и Украины в СНГ по запасам железной руды (16,6 млрд т). Месторождения находятся в основном в Северном Казахстане. Особое значение играют Качарское и Соколовско-Сарбайское месторождения.
Добыча металла
Среди руд, содержащих железо, сырьем для промышленного производства являются:
Красный железняк - гематит (Fe2O3; содержит до 70 % Fe). Гематит действительно имеет цвет запекшейся крови, который ему придают оксиды железа. Иногда буровато-красный оттенок гематита становится почти черным.
Бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей.
Гетит – не первое и далеко не единственное название природного гидроксида железа. С античных времен землистые разновидности гетита использовались как охристый или желтый пигмент для красок. Черный гетит растирался в пудру и использовался для приготовления темного лака.
Коллекционеры ценят гетит «парадной» внешности: с ярким алмазным блеском, просвечивающими кристаллами, объемными рельефами глянцевых горошин... Тонкоигольчатые сростки или волокнистые врастания в кварц могут давать шелковистый радужный отлив на полированной поверхности среза.
На берегах озера Онега (Кольский полуостров) находят зонированно окрашенные аметисты с врастаниями игл гетита. Такой камень зовут онегитом и используют для изготовления неординарных ювелирных украшений. Кварц с тонковолокнистыми врастаниями гетита называют волосатиком – и тоже поставляют в ювелирные мастерские.
Магнитный железняк – магнетит,FeFe2O4, Fe3O4; содержит 72,4 % Fe. Минерал магнетит образует октаэдрические кристаллы, кристаллические сростки и агрегаты, друзы, щётки, плотные зернистые и сплошные массы, вкрапленность в магматических горных породах. Минерал магнетит обладает сильными магнитными свойствами, притягивается магнитом. Минерал магнетит является главной рудой на железо.
Железный или серный колчедан – пирит, FeS2. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
Мелантерит — FeSO4·7H2O — реже встречается в природе и представляет собой хрупкие зеленые кристаллы (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском. Плотность равна 1,8—1,9 г/см.Используется в фармацевтической промышленности для производства железосодержащих препаратов.Основное месторождение этого металла находится в Бразилии. В последнее время внимание сосредоточивается на разработке конкреций, присутствующих на морском дне, в которых содержатся железо и марганец.
Марказит — FeS2 — содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6—4,9 г/см? и твёрдостью 5—6 по шкале Мооса.
Марказит – обычный железный колчедан, единоутробный брат пирита – только иной морфологии. Если кристаллы пирита образуют правильные кубы, то кристаллизация марказита идет подобно кристаллизации воды – лучами.
Красивые минералы железа
Многие могут думать, что железо может организовывать только неказистые черные камни, едва отличимые от земли. Но существуют минералы великолепного вида, благодаря содержанию внутри кристаллической решетки ионов железа.
Десятка самых красивых минералов железа:
1.Альмандин Al2Fe3(SiO4)3, самая твёрдая разновидность гранатов. Является Драгоценным камнем 4 категории.
2.Анапаит Ca2Fe[PO4]2·4H2O, редкий минерал с Краснодарского Края
3.Везувиан (Mg,Fe)2Ca10Al4[OH4(SiO4)5(Si2O7)2], найден в лаве Везувия, отличается крайне низким двупреломлением
4.Гумит(Mg,Fe)7(SiO4)3(F,OH)2, редкий минерал, также найденный в лаве Везувия, но только в 19 веке.
5.Кордиерит(Mg,Fe)2Al4Si5O18, имеет свойство менять окраску в зависимости от направления света, таким образом использовался мореплавателями для определении положения Солнца при пасмурном небе.
6.Лазулит (Mg,Fe)Al2(OH,PO4)2, не путать с Лазуритом и Азуритом, темно-синий минерал также со свойством изменения оттенка
7Сидерит FeCO3, карбонат железа, в мелкодисперсном состоянии может играть роль Железной Руды, но некоторые крупные красивые кристаллы могут придавать огранке
8.Хризолит (Mg,Fe)2SiO4, ювелирно-поделочный камень, его разновидность Оливин обычно находят внутри метеоритов
9.Эпидот Ca2Al2Fe(SiO4)3OH, образует длинные призматические кристаллы, которые иногда используют в ювелирном деле
10.Ярозит KFe3(SO4)2(OH)6, обычно образует мелкие кристаллы. Один из минералов, встречающихся также на Марсе
Заключение.
Из всего рассказанного можно сделать вывод.
Железо является одним из главных элементов в жизни человека. Практически все , что мы с вами видим или используем в жизни , железо является неотъемлемой его частью.
Приложение №7
Представитель ОАО «Соколовско-Сарыбайского горно-обогатительного объединения».
Костанайская область. Город Рудный. Именно здесь днем и ночью добывается железо. Место уникальное и не имеет аналогов в СНГ. Поразительным запасам железной руды на казахстанской земле удивились еще советские геологи. Месторождение было открыто совсем случайно. Пролетая над урочищем Сарбая летчик Сургутанов обратил внимание на стрелки компаса, которые все время отклонялись. Спустя три месяца здесь провели разведку и подтвердили – есть большая руда.
Железные руды – природные минеральные образования, содержащие железо и его соединения в таком объеме, когда промышленные извлечения железа из этих образований целесообразно. Несмотря на то, что железо входит в большем или в меньшем количестве в состав всех горных пород, под названием железных руд понимают только такие скопления железистых соединений из которых с выгодой в экономическом отношении можно получить металл.
Руду добывают на четырех карьерах: Сарабайском, Соколовском, Качарском и Куржункульском, а также на Соколовском подземном руднике, который работает порядком 40 лет.
Президент компании заверяет, что в скором времени здесь откроют еще 1 шахту, ведь запасы железной руды составляют 4 млрд. тонн. Сарбайский карьер считается здесь самым крупным, его глубина составляет 600м, производительность 6,5 млн тонн в год, содержание руды 38,5 %.
После геологоразведочных, маркшейдерских и буровых работ настает очередь самого зрелищного действа – взрыва. Следят за всем из диспетчерской, отсюда же производят запуск детонатора.
Увидеть взрывные работы удается не на всех предприятиях, ведь они производятся строго по плану и в определенное время. Застать 4 взрыва одновременно – большая удача. Производительность карьера достигла 17 млн тонн руды, проектная мощность 23 млн. Параметры с каждым годом увеличиваются и через лет 40 на этом месте будет карьер в 2 раза больше.
На руднике работает самая уникальная техника, которая позволяет поднимать за раз 30 кубометров руды. Таких машин в мире насчитывается всего 7 штук.
При таком темпе работ запасов руды хватит еще на 100 лет.
Предприятие ставит перед собой задачи по изменению технологических параметров, внедрению новых технологий и сохранение коллектива.
Соколовско-Сарбайское горно-обогатительное производственное объединение представлено двумя фабриками. Соколовско-Сарбайский горно-обогатительный комбинат образован в 1954 году на базе Соколовского и Сарбайского месторождения магнетитовых руд. ССГПО сегодня крупнейшее предприятие Казахстана и стран СНГ по подготовке железорудного сырья. Основная продукция флюсованные железорудные окатыши и железорудный концентрат. Это высококачественное сырье для доменного производства, соответствующего мировому стандарту и пользуется высоким спросом у металлургов. Весь процесс начинается отсюда. Руда поступает на фабрику рудоподготовки и обогащения при помощи железнодорожных вагонов и распределяется в приемный бункер. Работать здесь без средств индивидуальной защиты просто невозможно. Железная руда проходит сначала 5 ступеней дробления. Дробят руду 300 человек. В сутки в среднем перерабатывается 60 тонн. Эти 60 тонн далее измельчаются.
Фабрика рудоподготовки и обогащения это огромный комбинат, который живет 24 часа, производство не останавливается ни на минуту. Работают тут в 4 смены по 12 часов , полторы тысячи человек.
При помощи подобных шаров происходит измельчение руды до необходимого размера. Также существуют стержневые мельницы. Стержень весит 300кг, а один шарик весит 400г.В одну мельницу вмещается до 6 тонн шаров и 20 тонн стержней, обновляются они постоянно, один раз в четверо суток. Работают здесь 51 шаровая и стержневая мельница.
Вообще руды делятся на богатые и бедные, причем богатой называется такая руда, использование которой экономически выгодно в металлургической промышленности.
Непосредственная выплавка металлов из бедных руд нецелесообразно, дешевле ее обогатить. Для этого руду дробят и определенной технологией отделяют те частицы, в которых содержится много соединений металла, например, железные руды подвергаютсямагнитной сепарации.
Богатыесоединениями железа частицыруды отделяют от других магнитным полем. На барабан, оснащенныймагнитной системой прикрепляются частицы, обладающие магнитными свойствами и выделяются в отдельный продукт. Полученный концентрат имеет слишком малую фракцию и в доменную печь для выплавки металла его сыпать нельзя, его просто вынесет потоком газа. Поэтому концентрат спекают в окатыши на фабрике комкования. Увлажненная смесь обогащенного концентрата окомковывается в так называемых тарельчатых грануляторах или барабанах окомкователях, получаются шары в 10-30 мм, далее они обогащаются в 12 машинах при температуре 1100 градусов. Выделяется сера, которой дышать без маски просто невозможно. Фабрика производства окатышей образовалась в 1964 году. Предприятие является градообразующим, поэтому многие жители Рудного работают именно здесь. На фабрике работает 1000 человек, 300 из них женщины. Обоженные железорудные окатыши обладают очень высокой прочностью и идеально подходят для транспортировки на большие расстояния к металлургическим комбинатам в Магнитогорске, в Челябинске, в Китае, в Караганде и Темиртау. Железорудные окатыши и концентраты отправляются не только в Казахстанские компании, но и в зарубежные.
Литературный критик. В заключении этой конференции мне бы хотелось сказать вам, что в народном фольклоре много метких изречений о важности и значении железа в человеческом обиходе. В пословицах и поговорках всех народов мира железо отмечается прежде всего, как мерило необычайной прочности.
«Если ты настоящий человек, будь крепким, как сталь »(киргиз.)
«Терпеливый даже железо разорвет» (татар.)
«Холодное железо незачем ковать»(сербс.)
«Железо куется ,когда оно раскалится» (татарс.)
«Человека губит горе, железо портит влага» (турец.) (слайд)
«Старательный горы свернет, старанье железную веревку оборвет»(узбекс.)
«В народе без железа, как при обеде без соли»(русс.)
Сказка про железо.
Преподаватель Железный век продолжается. Примерно 9\10 всех сплавов используемых человечеством металлов и сплавов –это сплавы на основе железа. Железа выплавляется в 50 раз больше, чем алюминия, не говоря уже о прочих металлах.
В таблице Менделеева трудно найти какой-либо элемент, с которым так неразрывно связывалась бы жизнь всего человечества. Нет другого элемента, при участии которого проливалось бы так много крови, терялось бы столько жизней, происходило бы столько несчастий.
«В бою железо дороже золота»- гласит татарская пословица. И русские говорили: «При рати железо дороже золота. Железом и золото добуду». Железо являлось основным металлом, из которого изготовляли многочисленные и разнообразные орудия для истребления людей. Недаром копье и щит, характерные принадлежности бога войны Марса, древние мудрецы сделали символом, обозначающим железо. Оно действительно верно и безотказно служило Марсу.
Более 90% всех металлов, которые использовались в Великой Отечественной войне, приходится на железо. Железо- главная составная часть чугунов и сталей, а по их выплавке судят о мощности государства. Сколько этого металла было выброшено в снарядах, бомбах, минах, гранатах! Чтобы судить о масштабах расхода железа в минувшей войне, назовем одну цифру: миллион бомб сброшено фашистской авиацией на Сталинград. Но железо не только борьба, война, разрушение; железо- металл созидания. Это основа всей металлургии, машиностроения, железнодорожного транспорта, судостроения, грандиозных инженерных сооружений.
Железу еще долго быть фундаментом цивилизации.
Хотелось бы поблагодарить всех за предоставленную информацию.


























