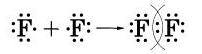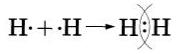СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Ионная химическая связь.
- Познакомить учащихся с понятием ионной химической связи.
- Объяснить механизм образования ионной связи.
- Рассмотреть примеры веществ с ионной связью.
Просмотр содержимого документа
«Ионная химическая связь.»
План-конспект урока по теме Ионная химическая связь
Тип урока: комбинированный.
Цель:
- Познакомить учащихся с понятием ионной химической связи.
- Объяснить механизм образования ионной связи.
- Рассмотреть примеры веществ с ионной связью.
Задачи
1. Обучающие:
- Объяснить суть ионной связи.
- Рассмотреть примеры простых и сложных ионов.
- Научить определять отличие ионной связи от ковалентной.
2. Развивающие:
- Развивать навыки анализа химических веществ.
- Формировать умение работать с таблицей Менделеева.
3. Воспитательные:
- Воспитывать интерес к изучению химии.
- Формировать ответственность за выполнение учебных заданий.
Учебно-методическое обеспечение: учебник, рабочая тетрадь, сборники задач по химии, памятки к уроку.
Ход урока:
1. Организационный момент
- Приветствие.
- Проверка выполнения домашних заданий.
- Объявление темы урока.
На прошлом уроке мы с вами продолжали изучение видов ковалентной связи и понятие электроотрицательности, объясняли почему формулы записываются именно таким образом. Дома Вам необходимо было это закрепить упр. 5,6 после пар 17. Какие вопросы?
Сегодня на уроке каждый получит оценку за знание теории прошлой темы (тест) плюс активная работа на уроке.
Проверка Д/з
Тест (максимальная оценка 5 баллов).
Вариант 1
1.Выберите правильное утверждение. Электроотрицательность- это:
А) способность атомов химических элементов притягивать к себе общие электронные пары, участвующие в образовании химической связи;
Б) сила притяжение атомом данного химического элемента общей электронной пары в молекуле;
В) химическая связь, в результате которой образуются общие элетронные пары.
2. Выберите правильное утверждение. Между атомами в молекуле азота:
А) тройная связь
Б) одинарная связь
В) ковалентная неполярная связь
Г) ковалентная полярная связь
3.Выберите правильное утверждение. Величина ЭО атомов в химическом ряду кремний, калий, азот, кислород, хлор, фтор:
а) сначала возрастает, а затем убывает; б) возрастает; в) убывает; г) вначале возрастает , а потом убывает.
4.Выберите правильное утверждение. Неполярной является молекулы:
А) Н2, НF ,НCL;
Б) CH 4, CO2, O2,
В) HBr, N 2, H 2O, H2
Г) Н 2; O2; N 2
5. Составьте электронную формулу молекулы хлороводорода.
Вариант 2
1.Выберите правильное утверждение. Ковалентная неполярная- это:
А) способность атомов химических элементов притягивать к себе общие электронные пары, участвующие в образовании химической связи;
Б) ) химическая связь, в результате которой образуются общие элетронные пары между атомами неметаллов разными;
В) химическая связь, в результате которой образуются общие элетронные пары между атомами неметаллов одинаковыми.
2. Выберите правильное утверждение. Между атомами в молекуле кислорода:
А) тройная связь
Б) двойная связь
В) ковалентная неполярная связь
Г) ковалентная полярная связь
3.Выберите правильное утверждение. Величина ЭО атомов в химическом ряду кремний, натрий, азот, кислород, хлор, фтор:
а) сначала возрастает, а затем убывает; б) возрастает; в) убывает; г) вначале возрастает , а потом убывает.
4.Выберите правильное утверждение. Полярной является молекулы:
А) Н2, НF ,НCL;
Б) CH 4, CO2, O2,
В) HBr, N 2, H 2O, H2
Г) Н 2; O2; N 2
5. Составьте электронную формулу молекулы фтороводорода.
Учащиеся обмениваются листочками со своими ответами между собой и на полях сами выставляют отметки.
3.Актуализация знаний и умений учащихся и изучение нового материала.
- Вопросы для повторения:
- Что такое атом и молекула?
- Какие виды химических связей вы знаете?.
4. Целеполагание: учащимся предлагаются для обсуждения следующие вопросы:
1. Что общего между молекулами, которые записаны на доске? (Ответ: неметаллы)
2. Какие из формул второго ряда относятся к ковалентным полярным? (Ответ: соляная кислота)
В процессе обсуждения объявляется цель и тема урока.
Памятка к уроку
1.Если общая электронная пара образуется между атомами неметаллов разными и по значению ЭО, то общая электронная пара практически полностью
смещается в сторону более электроотрицательного атома.
2.Ионная связь образуется между атомами 1А и 2 А (типичные металлы) с одной стороны и 6А и 7 А группами с другой ( типичные неметаллы).
3. Ионы – атомы или группа атомов (частицы), которые имеют положительный или отрицательный заряд.
4. Ионы бывают: а) простые ( Н+, Nа+) и сложные (SО42-; РО43-)
Б) положительные (катионы) и отрицательные (анионы)
5.Одноименные частицы отталкиваются, а разноименные притягиваются (природа химической связи)
6. Ионная связь - химическая связь, которая возникает за счет притяжения разноименных ионов.
7. К веществам с ионной связью относят: соли, оксиды, основания.
8. Атомы металла при образовании ионной связи, как правило, отдают электроны, а атомы неметалла, как правило, принимают электроны.
5. Физкультминутка
6. Закрепление новых знаний: Закрепление материала
- Работа с примерами:
- Рассмотрение молекул NaCl, CaO, KBr.
- Определение, какие ионы образуются при ионной связи.
- Выполнение практического задания:
- Составить формулы для простых и сложных ионов.
7. Домашнее задание:
- Подготовить информацию о каком-либо ионном соединении: его свойства, применение, способы получения.
8. Подведение итогов урока: сегодня на уроке мы с вами изучили еще один тип химической связи.
1. Ребята, нам удалось сохранить доброжелательную атмосферу к концу урока?
2. Научились ли мы определять в зависимости от молекулярной формулы, относится ли данное вещество к веществу с ионным типом связи?
3. Что было самым трудным?
4. Что нужно сделать, чтобы избежать трудностей?
У каждого из вас на столах есть цветные кружочки. Уходя из кабинета, я предлагаю Вам распределить их по 3 сосудам: самый большой - я доволен на уроке собой и справлюсь с предложенным домашнем заданием; средний – для успешного выполнения домашнего задания мне необходимо еще раз внимательно изучить пар; самый маленький – сегодня я работал неактивно и возможно домашнее задание выполнять не буду.
Без воды человек может прожить очень не долго. Потребность в воде стоит на втором месте после кислорода. Без еды человек может прожить около шести недель, а без воды – пять-семь суток. За всю свою жизнь человек выпивает примерно 35 т воды.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы.
«Ковалентная химическая связь»
Дата проведения:
Раздел:
Цель: углубить и расширить знания о причинах возникновения ковалентной химической связи.
Задачи:
- обучения: сформировать знания о ковалентной химической связи, научить писать структурные формулы.
- развития: развитие химического языка, логического мышления;
- воспитания: воспитывать умения работать самостоятельно и в группе, формирование эстетического чувства при аккуратном заполнении тетрадей.
Тип урока: текущий, комбинированный.
Методы и приемы обучения: индивидуальный и фронтальный опрос, рассказ, объяснение, демонстрация.
Средства обучения: учебники, дидактические материалы.
Ход урока:
|
Запись на доске и в тетрадях Объяснение Запись на доске и в тетрадях Запись в тетрадях Запись на доске и в тетрадях
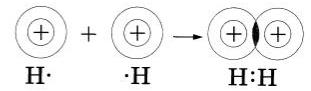
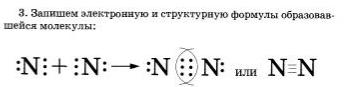
Запись на доске и в тетрадях | 1. – Здравствуйте! Присаживайтесь! 2. Актуализация знаний (10 мин) На прошлом уроке мы изучали тему «Природа химической связи». ТЕСТ (ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ). 1.К двухатомным молекулам относятся молекулы: а) хлора; б) натрия; в) гелия; г) серная кислота. 2.Химическая связь – это … А) взаимодействие, которое связывает отдельные атомы в более сложные системы; Б) реакция, в результате которой из одного вещества образуются несколько новых веществ; В) вещество, которое состоит из нескольких атомов. 3. Природа химической связи является…. 4. При образовании химической связи энергия: а) выделяется; б) поглощается. 5. Причина образования химической связи …… 6. Сколько электронов на втором слое у атома максимально может находиться: а)2; б) 8; в)18; г) 32. 7. К основным типам химической связи относятся: а) ковалентная; б) ионная; в) металлическая. 8. До завершения 3. Изучение нового материала (25 мин) Сегодня мы продолжаем изучение типов химической связи. Тема называется « Ковалентная связь». Мы уже рассмотрели, как взаимодействуют атомы элементов-металлов с атомами элементов-неметаллов: одни отдают свои внешние электроны и превращаются при этом в положительные ионы, другие принимают электроны и превращаются при этом в отрицательные ионы. Ионы притягиваются друг к другу, образуя ионные соединения. А как осуществляется связь между атомами элементов-неметаллов, которые имеют сходную тенденцию к присоединению электронов? Рассмотрим вначале, как осуществляется связь между атомами одного и того же химического элемента, например в веществах, имеющих двухатомные молекулы: азота — N2, водорода — Н2, хлора — СL2. Обратите внимание, что для отражения состава этих веществ с помощью химических знаков также пользуются индексами. Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом: обобществив свои внешние электроны, то есть сделав их общими для обоих атомов. Рассмотрим, например, образование молекулы фтора F2. Атомы фтора — элемента главной подгруппы VII группы — имеют на внешнем электронном уровне семь электронов, и каждому атому не хватает до его завершения лишь одного электрона. Внешние электроны атома фтора образуют три электронные пары и один непарный электрон: Если сближаются два атома и у каждого из них есть но одному внешнему неспаренному электрону, то эти электроны «объединяются» и становятся общими для обоих атомов, у которых тем самым сформируется завершенный внешний восьми электронный уровень. Химическую связь, возникающую в результате образования общих электронных пар, называют атомной или ковалентной. Образование молекулы фтора изображено на схеме: Если обозначить общую электронную пару черточкой, то запись называют структурной формулой, например структурная формула фтора F-F. Аналогично молекуле фтора образуется и двухатомния молекула водорода Н2. следует учесть только, что завершенным для атома водорода будет двухэлектронный уровень, подобный завершенному уровню атома гелия. Структурная формула молекулы водорода Н—Н. Попытаемся уточнить наши представления об образовании ковалентной связи на примере возникновения молекулы водорода, используя понятие электронного облака (см. §). При сближении двух атомов водорода, имеющих по одному электронному облаку сферической формы, происходит перекрывание электронных облаков. При этом возникает область (место), где плотность отрицательного заряда наиболее высока и поэтому обладает повышенным отрицательным зарядом. Положительно заряженные ядра притягиваются к ней (это известно из курса физики), и образуется молекула. Таким образом, химическая связь- результат действия электрических сил. Нужно отметить, что в основе образования ковалентной связи так же, как и при возникновении ионной связи, лежит взаимодействие противоположных зарядов. Следует подчеркнуть, что формальное понятие электронной пары при более точном рассмотрении природы ковалентной связи заменяется понятием — перекрывание электронных облаков, которое приобретает определенный физический смысл. В заключение рассмотрим алгоритмы рассуждений, необходимых для того, чтобы записать схему образования ковалентной связи, например для молекулы азота N3. 1.Азот — это элемент главной подгруппы V группы. Его атомы имеют по пять электронов на внешнем уровне. Чтобы определить число неспяренных электронов, воспользуемся формулой: 8 — N = число неспарепных электронов. где N — номер группы химического элемента. Следовательно, атомы азота будут иметь (8-5 = 3) три неспаренных электронов. 2. Запишем знаки химических элементов с обозначением внешних электронов так, чтобы неспаренные электроны были обращены к соседнему знаку: Если атомы связаны между собой одной общей электронной парой, то такую ковалентную связь называют одинарной, если двумя - двойной, если тремя — тройной. 4.ПОДВЕДЕНИЕ ИТОГОВ. Расстояние между ядрами соседних атомов называется длиной связи: чем больше общих электронных пар, тем прочнее связь. Выполняют задания у доски, объясняют механизм образования связи: - одинарная связь: Н - Н,F - F - двойная связь: О=О, S=S - тройная связь: N=N, P=P Запишем домашнее задание: параграф 10, стр. 59 – 62 Урок окончен. Всем спасибо за работу. До свидания!
|
Тест – обобщение по теме « оксиды углерода и кремния. Угольная и кремниевая кислоты»
1.Оксид углерода (IV) это:
а) кислотный; б) основный; в) амфотерный; г) солеобразующий; д) несолеобразующий.
2. Для угарного газа характерны: а) восстановительные свойства; б) окислительные свойства; в) окислительно – восстановительные свойства.
3. Оксид кремния (IV) имеет: а) молекулярное строение; б) немолекулярное строение.
4. В каком ряду правильно записаны названия следующих солей К2SiO3, Nа2СО3; Са (НСО3)2 :
а) силикат калия, гидрокарбонат натрия, карбонат кальция;
б) карбонат кальция, силикат натрия, гидрокарбонат кальция
в) силикат калия, карбонат натрия, гидрокарбонат кальция.
5. Где применяет оксид углерода (IV):
а) тушение пожаров; б) в строительстве; в) в производстве моющего; г) в фармацевтической промышленности; д) «сухой лед».
6. Составьте уравнение, отвечающие реакции карбоната калия с соляной кислотой. Запишите это уравнение в сокращенном виде.
7. Силикаты каких металлов называют растворимыми стеклами: а) калия; б) натрия; в) кальция; г) магния.
8. Рассчитайте массовую долю кремния в кремниевой кислоте.
9. Осуществите цепочку превращений:
10. Определите массу воды, необходимой для приготовления 10% -ного раствора карбоната натрия из кристаллической соды массой 54 г.
Конспект учебного занятия по теме «Типы химической связи. Ковалентная связь»
Тема урока: Ковалентная связь
Тип урока: Освоение новых знаний.
Цели:
-образовательная: раскрыть сущность образования химической связи между атомами, сформировать понятие о ковалентной связи.
-развивающая: формировать умение записывать схемы образования ковалентной связи, продолжить развитие умений анализировать, выделять главное в изучаемом учебном материале, делать выводы;
-воспитательная: воспитывать интерес к предмету, самостоятельность, умение работать в коллективе.
Оборудование:
периодическая система химических элементов Д.И.Менделеева;
учебник; коллекция моделей атомов
«Механизмы образования ковалентной химической связи» -презентация
От берега до берега
Можно сделать мост.
Соединить два атома
В молекулу – вопрос…
ХОД УРОКА:
Орг. момент.
Добрый день, ребята и гости! Давайте улыбнемся друг другу. Пусть сегодняшний урок принесет нам всем радость общения. Сегодня на уроке, ребята, вас ожидает много интересных заданий, новых открытий, а помощниками вам будут: внимание, находчивость, смекалка.
Тест- обобщение по теме: «Строение атома и систематизация химических элементов»
Укажите номер периода и номер группы, в которых находится магний:
3 период, 2 А группа;
2 период, 3 А группа
1 период, 4 А группа
3 период, 5 А группа
Чему равно число электронов:
Порядковый ( атомный) номер;
Число протонов
Заряд ядра
Массовое число
Составьте электронную схему атомов натрия и калия.
Как изменяется радиус атомов в ряду бериллий, магний, кальций:
уменьшается
увеличивается.
По электронной схеме определите элемент и укажите сколько электронов не хватает для завершения электронного слоя: 2е,8е, 3е.
К щелочным металлам относятся: а) литий, натрий, калий; б) бериллий, магний, кальций.
Завершенный внешний энергетический уровень имеет:
Гелий
Бериллий
Азот
Фосфор
Наиболее выраженными металлическими свойствами обладает:
Кальций, магний, бериллий
Калий, фосфор, бром
Натрий, водород, литий.
Высший оксид состава Э2О7 имеет:
Хлор
Сера
Магний
Натрий
Чему равно число нейтронов атома бария?
ПАМЯТКА
ХИМИЧЕСКАЯ СВЯЗЬ
Химическая связь — это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, кристаллы и др.).
Природа химической связи – электростатическую (притяжения частиц с разноименными зарядами и отталкивания частиц с одноименными зарядами).
Условие образования химической связи: выделяться энергии.
Причина образования химической связи: стремления к максимально устойчивому состоянию.
Типы химической связи — ковалентную, ионную и металлическую.
Ковалентная связь — это химическая связь, возникающая за счет образования общих электронных пар между атомами.
Общая электронная пара, связывающая атомы, принадлежит им одновременно.
Ковалентная связь, образованная одной электронной парой, называется одинарной, двумя — двойной и тремя общими электронными парами — тройной связью.
Ковалентная связь между атомами одного и того же неметалла называется неполярной.
Электроотрицательность элемента (ЭО)— условная величина, характеризующая способность его атомов притягивать к себе валентные электроны.
С ростом атомного номера элемента электроотрицательность увеличивается в периодах слева направо, а в главных группах убывает сверху вниз.
Ковалентная связь между атомами элементов с разной электроотрицательностью называется полярной.
Ионная химическая связь — это связь, осуществляемая за счет электростатического взаимодействия противоположно заряженных ионов.
Ионная связь возникает между атомами элементов, которые сильно отличаются по величине электроотрицательности.
Рефлексия
А теперь я каждого попрошу ответить из предложенных вопросов (вопросы предварительно размещены на доске):
Сегодня я узнал…
Я почувствовал, что…
Мне представляется интересным то, что…
Я бы хотел (а) еще раз услышать…
Работа над заданием помогла мне…
Меня удивило…
У меня появилось желание…
Заполните таблицу, пользуясь Периодической системой химических элементов.
Вариант 2.
| Характеристика химического элемента |
|
| ||
| К | S | |||
| Порядковый номер |
|
|
|
|
| Заряд ядра атома |
|
|
|
|
| Число протонов |
|
|
|
|
|
|
|
|
|
|
| Число электронов |
|
|
|
|
| Число нейтронов |
|
|
|
|
| Атомная масса |
|
|
|
|
Заполните таблицу, пользуясь Периодической системой химических элементов.
Вариант 1.
| Характеристика химического элемента |
|
| ||||
| Na | P | |||||
| Порядковый номер |
|
|
|
| ||
| Заряд ядра атома |
|
|
|
| ||
| Число протонов |
|
|
|
| ||
|
|
|
|
|
| ||
| Число электронов |
|
|
|
| ||
| Число нейтронов |
|
|
|
| ||
| Атомная масса |
|
|
|
| ||
|
|
|
|
|
| ||
V : вступительного испытания по химии 10 класс Вариант 1 Часть А Выберите из предложенных вариантов ответов один правильный 1. Сколько протонов и электронов содержится в ионе НС03~? а) 62; б) 63; в) 64; г) 65. 2. В малых периодах с ростом заряда ядра атомов: а) усиливаются металлические свойства и ослабевают неметаллические б) ослабевают металлические свойства и усиливаются неметаллические в) усиливаются и металлические, и неметаллические г) ослабевают и металлические, и неметаллические 3. Какая степень окисления марганца в ионе MnO,t2~? а) +6; б) +7; в) +5; г) +4. 4. Na2S и H2S относятся соответственно к веществам со следующими видами химической связи: а) ковалентная полярная, ковалентная неполярная; б) ионная, ковалентная неполярная; в) ионная, ионная; г) ионная, ковалентная полярная; 5. Отметьте схему реакции замещения: a) CuO + AgF—; б) СаО + H N03—»; в) А1 + Fe20 3—; г) С2Н, + Вг2-+. 6. Укажите уравнение окислительно-восстановительной реакции: а) CuS04 % CuO + S 0 3 в) СиСОз -» СиО + С 0 2 б) 2Cu(N 03)2 -► 2Cu0 + 4N 02 + 0 2 г) (Си0Н)2С 0 3 - 2СиО + С 0 2 + Н20 7. Укажите восстановитель в следующей окислительно восстановительной реакции: 2С12 + Z r02 + 2С — ZrCl2 + 2СО а) С1°; б) Zr+4; в) О ; г) С0 8. Растворимость простого вещества кислорода в воде с повышением температуры: а) уменьшается; б) увеличивается; в) быстро нарастает; г) не изменяется. 9. С какими из веществ, формулы которых приведены ниже, взаимодействует натрий: 1) Н20; 2) S; 3) Си(ОН)2; 4) Ba(N03)2; 5) 0 2 а) 1,2, 3; б) 1, 2, 5; в) 2, 3, 4; г) 1, 4, 5 10. Сокращенному ионному уравнению Н+ + ОН' = Н20 соответствуют следующие молекулярные уравнения: a) H2SO, + Cu(OH)2 = C11SO4 + 2Н20; б) 2HN03 + Ва(ОН)2 = Ba(N03)2 + 2Н20; в) H2S 0 4 + Ва(ОН)2 = BaS04+ 2Н20; г) NaHS04 + NaOH = Na2S 04 + Н20. 11. Какое вещество не реагируют с натрий-гидроксидом? a) (NH4)2S 0 4; б) K N 03; в) ZnO; г) S 0 2. 12.Какая реакция в водном растворе являются необратимой? a) NaOH + NH4N 0 3-*; б) MgS04 + CuCl2-; в) ВаС12 + КОН-; г) ZnCl2 + НВг-*. 13. В 100 г Н20 растворили 50 г H2S 04. Какова массовая доля вещества в растворе: а) 26,5 %; б) 33,3 %; в) 48,4 %; г) 50 %. 14 .Укажите ряд веществ, с помощью которых можно последовательно осуществить следующие превращения Fe — FeS04 —FeCl2 —* Fe — FeCl3: a) H2S 0 4 конц.; NaCl; Си; HC1; 6) H2S 0 4 разб.; HC1; Na; MgCl2; в) CuS04; BaCl2; Mg; Cl2; r) Na2S 0 4; Cl2; t°; KC1. 15. В каких случаях протекают реакции ионного обмена между раствором FeCl2 и растворами следующих веществ: 1)H2S 0 4 2) NaN03 3) NaOH 4) Na2C 0 3: a) 1, 4; б) 2, 3; в) 3, 4; г) 1, 4. 16. Сколько атомов азота содержится в 33,6 дм3 (при н.у.) NH3? а) 9,03 ■ 1023; б) 12,06 1023; в) 15,05 • 1023; г) 18,06 ■ 1023. 17. Массовая доля кислорода в карбонате аммония равна: а) 55 %; б) 50 %; в) 63 %; г) 74 %. 18. В химическую реакцию между собой вступают: a) NaCl и Zn б) AgN03 и Fe в) FeS04 и Ag г) H2S 04 и Аи 19. Выберите названия реакций характерных для метана 1 Присоединение галогенов 2)замещение атомов водорода на атомы галогенов 3) горение на воздухе 4) реакция полимеризации а) 2, 4; б) 1,4; в) 2,3; г) 1,2,3. 20. Вещество состава CH3NH2 относится к: а) аминокислотам в) спиртам б) аминам г) карбоновым кислотам Часть Б 1.Изобразите структурную формулу вещества: 2, 3 - диметилгексен-1 и постройте к нему 1 изомер, назовите его. 2.Запишите уравнения химических реакций, уравнение 4 запишите в полном и кратком ионном виде. Са — СаО - Са(ОН)2 - СаС12 - Ca(N03)2 4. Некоторый элемент проявляет в оксиде степень окисления +4. Массовая доля этого элемента в оксиде составляет 50 %. Какой элемент образует оксид? 5. Какую массу 10%-го раствора серной кислоты нужно взять для нейтрализации 600 см3 20%-го раствора гидроксида натрия (рр.ра = 1,15
Химическая разминка
Разминку готовят и проводят ученики.
Ученик. Анаграммы – это слова, в которых изменен порядок букв. Попробуйте разгадать некоторые из химических анаграмм. Переставьте буквы в каждом слове и получите название химического элемента. Обратите внимание на подсказку.
«Одоврод» – у этого элемента самая маленькая относительная атомная масса.
«Маилинюй» – этот элемент называют «крылатым» металлом.
«Тьурт» – содержится в медицинском градуснике.
«Цалький» – без него наши кости были бы непрочными и хрупкими.
«Росфоф» – веществом, состоящим из атомов этого элемента, была намазана шерсть собаки Баскервилей.
| Последовательность действий | Составление формулы оксида фосфора |
| 1. Написать символы элементов | Р О |
| 2. Определить валентности элементов | V II |
| 3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
| 4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
| 5. Записать индексы при символах элементов | Р2 О5 |
| 6. Формула соединения (оксида) | Р2О5 |
Контрольная работа № 1
Введение в органическую химию. Алканы.
Вариант 1.
1.Из предложенного перечня выберите названия органических веществ: а) метан; б) крахмал; в) серная кислота; г) глюкоза
2.Из предложенного перечня укажите («+» или «-») правильность утверждения:
а) чем больше молярная масса алкана, тем выше его температура кипения и плавления;
б) длина связи у алканов ровна 0, 155 нм
в) метан – это бесцветный газ, легче воздуха, не имеющих запаха.
г) валентность атома углерода в органических соединениях всегда равна V.
3. Какие из перечисленных молекулярных формул относятся к алканам: а) СН4; б) С 2Н6; в) С3Н6
4. Из предложенного перечня выберите названия алкана, которые при н.у. являются жидкостями:
а) бутан; б) гексан;
в) метан; г) этан
5. Составьте структурную формулу 2- метил – 3 хлоргексана
6. Приведите названия по систематической номенклатуре 2 изомеров (на ваш выбор) с молекулярной формулой С6Н14. Назовите вещества.
7. Массовая доля водорода в ряду пропан, бутан:
а) увеличивается
б) уменьшается.
Свой ответ подтвердите расчетами.
8. В каком уравнении сумма коэффициентов больше:
А) пропан +О2=
Б) бутан +О2=
9. Составьте уравнения предложенных реакций, назовите продукты и укажите к какому типу относятся :
А) метан+О2 =
Б) Этан + 2 Сl2 =
В) СН3СООNa+ NaOH(ТВ)=
10. Установите формулу алкана, в котором массовая доля углерода равна 84%.
Контрольная работа № 1
Введение в органическую химию. Алканы.
Вариант 2.
1.Из предложенного перечня выберите названия органических веществ природного происхождения : а) нефть; б) полиэтилен; в) природный газ; г) бензин
2.Из предложенного перечня укажите («+» или «-») правильность утверждения:
а) изомеры имеют одинаковый качественный и количественный состав;
б) длина связи у алканов ровна 0, 155 нм
в) пропан является газом.
г) валентность атома кислорода в органических соединениях всегда равна двум.
3. Из предложенного перечня выберите названия алкана, которые при н.у. являются газами:
а) бутан; б) гексан; в) метан; г) этан
4. Какие из перечисленных молекулярных формул относятся к алканам: а) С 2Н4; б) С 3Н8; в) С4Н10
5. Составьте структурную формулу 3- метил – 3 хлоргептана
6. Приведите названия по систематической номенклатуре 2 изомеров (на ваш выбор) с молекулярной формулой С7Н16. Назовите вещества.
7. Массовая доля водорода в ряду пентан, бутан: а) увеличивается; б) уменьшается.
Свой ответ подтвердите расчетами.
8. В каком уравнении сумма коэффициентов больше:
А) пентан +О2= Б) бутан +О2=
9. Составьте уравнения предложенных реакций, назовите продукты и укажите к какому типу относятся :
А) Этан+О2 =
Б) Метан + 2 Сl2 =
В) СН3СООNa+ NaOH(ТВ)=
10. Установите формулу алкана, в котором массовая доля углерода равна 82,76%.
Контрольная работа № 1
Строение атома и периодический закон.
Вариант 1
Из ряда элементов Н, Na, К, Мg, F, Fe выберите элементы IА группы. Расположите их в порядке увеличения атомных номеров
Чему равен заряд ядра, число протонов,число нейтронов и число электронов в атоме каждого из нуклидов:35Сl, 40К, 56Fe
Составьте электронные схемы , а затем электронные конфигурации и электронографические схемы атомов и ионов: алюминия, кремния и S-2
Определите суммарное число протонов, нейтронов и электронов нитрите кальция химическим количеством 1 моль.
Массовая доля кислорода в оксиде металла равна 0,471. Определите, какой это металл, если степень окисления его атомов в данном оксиде равна +3
Контрольная работа № 1
Строение атома и периодический закон.
Вариант 2
Из ряда элементов Н, Na, Са, Мg, F, Fe выберите элементы IΙА группы. Расположите их в порядке увеличения атомных номеров
Чему равен заряд ядра, число протонов,число нейтронов и число электронов в атоме каждого из нуклидов:32S, 40 Ca, 31Р
Составьте электронные схемы , а затем электронные конфигурации и электронографические схемы атомов и ионов: фосфора, фтора и Сl-
Определите суммарное число протонов, нейтронов и электронов карбонате кальция химическим количеством 1 моль.
Массовая доля кислорода в оксиде металла равна 0,7143. Определите, какой это металл, если степень окисления его атомов в данном оксиде равна +2.
Строение атома и периодический закон.
Вариант 1
Из ряда элементов Н, Na, К, Мg, F, Fe выберите элементы IА группы. Расположите их в порядке увеличения атомных номеров
Чему равен заряд ядра, число протонов,число нейтронов и число электронов в атоме каждого из нуклидов:35Сl, 40К, 56Fe
Составьте электронные схемы , а затем электронные конфигурации и электронографические схемы атомов и ионов: алюминия, кремния и S-2
Определите суммарное число протонов, нейтронов и электронов нитрите кальция химическим количеством 1 моль.
Массовая доля кислорода в оксиде металла равна 0,471. Определите, какой это металл, если степень окисления его атомов в данном оксиде равна +3
Контрольная работа № 1
Строение атома и периодический закон.
Вариант 2
Из ряда элементов Н, Na, Са, Мg, F, Fe выберите элементы IΙА группы. Расположите их в порядке увеличения атомных номеров
Чему равен заряд ядра, число протонов,число нейтронов и число электронов в атоме каждого из нуклидов:32S, 40 Ca, 31Р
Составьте электронные схемы , а затем электронные конфигурации и электронографические схемы атомов и ионов: фосфора, фтора и Сl-
Определите суммарное число протонов, нейтронов и электронов карбонате кальция химическим количеством 1 моль.
Массовая доля кислорода в оксиде металла равна 0,7143. Определите, какой это металл, если степень окисления его атомов в данном оксиде равна +2
ПАМЯТКА
СТРОЕНИЕ АТОМА
Атом — электронейтральная частица, состоящая из положительно за- ряженного ядра и отрицательно заряженных электронов.
Атом имеет сложное строение, доказательством чего является: а) явление радиоактивности; б) наличие электронов
ЯДРО АТОМА= ПРОТОНЫ И НЕЙТРОНЫ
Протон (р) – положительная частица, имеет массу равную 1u
1u =1,66 *10-27 кг=1,66*10-24г
Нейтроны – электронейтральны
Электроны- отрицательные, имеют массу равную 1/1840
Атомный (порядковый) номер = число электронов = число протонов = заряд ядра
Свойства атомов химических элементов, а также состав и свойства образуемых ими веществ находятся в периодической зависимости от зарядов атомных ядер.
А = Z + N, где А- массовое число; Z - число протонов; N – число нейтронов
Нуклид - вид атомов с определенным значением атомного номера и массового числа.
Изотопы - это нуклиды, имеющие одинаковый атомный номер (т. е. одинаковое число протонов в ядре), но различные массовые числа.
Изотопы водорода: 11 H- протий, 21 H- дейтерий, 31 H – тритий.
Химический элемент — вид атомов с одинаковым зарядом ядра
Относительная атомная масса элемента — физическая величина, кото- рая показывает, во сколько раз средняя масса атомов данного химичес- кого элемента больше 1 12 части массы нуклида углерода-12 (12С).
Радиоактивностью называется самопроизвольное превращение не- устойчивых атомных ядер в другие ядра, сопровождающееся испуска- нием различных частиц.
План урока : 1) Химические свойства кислорода; 2) химические свойства серы; 3)применение простых веществ кислорода, серы.
| Вещество | Правило | Уравнение реакции | Тип реакции | Кто окислитель, кто восстановитель |
| кислород | Металл+ О2 =основный ( амфотерный) оксид | 2Са+ О2 = 2СаО | Соединение, ОВР | Са – восстановитель, О2 - окислитель |
План урока : 1) Химические свойства кислорода; 2) химические свойства серы; 3)применение простых веществ кислорода, серы.
| Вещество | Правило | Уравнение реакции | Тип реакции | Кто окислитель, кто восстановитель |
| кислород | Металл+ О2 =основный ( амфотерный) оксид | 2Са+ О2 = 2СаО | Соединение, ОВР | Са – восстановитель, О2 - окислитель |
План урока : 1) Химические свойства кислорода; 2) химические свойства серы; 3)применение простых веществ кислорода, серы.
| Вещество | Правило | Уравнение реакции | Тип реакции | Кто окислитель, кто восстановитель |
| кислород | Металл+ О2 =основный ( амфотерный) оксид | 2Са+ О2 = 2СаО | Соединение, ОВР | Са – восстановитель, О2 - окислитель |
План урока : 1) Химические свойства кислорода; 2) химические свойства серы; 3)применение простых веществ кислорода, серы.
| Вещество | Правило | Уравнение реакции | Тип реакции | Кто окислитель, кто восстановитель |
| кислород | Металл+ О2 =основный ( амфотерный) оксид | 2Са+ О2 = 2СаО | Соединение, ОВР | Са – восстановитель, О2 - окислитель |
План урока : 1) Химические свойства кислорода; 2) химические свойства серы; 3)применение простых веществ кислорода, серы.
| Вещество | Правило | Уравнение реакции | Тип реакции | Кто окислитель, кто восстановитель |
| кислород | Металл+ О2 =основный ( амфотерный) оксид | 2Са+ О2 = 2СаО | Соединение, ОВР | Са – восстановитель, О2 - окислитель |
План урока : 1) Химические свойства кислорода; 2) химические свойства серы; 3)применение простых веществ кислорода, серы.
| Вещество | Правило | Уравнение реакции | Тип реакции | Кто окислитель, кто восстановитель |
| кислород | Металл+ О2 =основный ( амфотерный) оксид | 2Са+ О2 = 2СаО | Соединение, ОВР | Са – восстановитель, О2 - окислитель |
Тест по теме: «Кислород и сера – элементы VIА группы»
1. Заполните пробелы в утверждениях:
А. Кислород и сера - элементы ……. . группы ………. . подгруппы.
Б. Заряд ядра атома кислорода равен …….
В. В ядре атома кислорода содержится …… протонов, …… нейтронов, …. . электронов.
Г. Атомы кислорода и серы имеют на внешнем уровне …. . электронов.
Д. Кислород имеет степень окисления в соединениях ……. и является в ходе химической реакции …………. .
Е. Сера имеет степени окисления в соединениях …………… и является в ходе химической реакции и окислителем, и …………. .
Ж. Аллотропные модификации кислорода: …………….
2. Исправь ошибку и запиши правильно уравнения
Na + O = Na2O
S + F2 = SF6
Fe + S2 = FeS
P + O2 = PO5
S + Cl2 = SCl2
S + H2O = H2S + O2
3. Определите степень окисления и валентность серы в соединениях: сульфид кальция, сульфит кальция, сульфат кальция.
4. Вычислите массовые доли серы и хлора в соединении серы с хлором SCl4.
5. Какой объем оксида серы (IV) образуется при сжигании серы в 10 л воздуха?
Тест по теме: «Кислород и сера – элементы VIА группы»
1. Заполните пробелы в утверждениях:
А. Кислород и сера - элементы ……. . группы ………. . подгруппы.
Б. Заряд ядра атома кислорода равен …….
В. В ядре атома кислорода содержится …… протонов, …… нейтронов, …. . электронов.
Г. Атомы кислорода и серы имеют на внешнем уровне …. . электронов.
Д. Кислород имеет степень окисления в соединениях ……. и является в ходе химической реакции …………. .
Е. Сера имеет степени окисления в соединениях …………… и является в ходе химической реакции и окислителем, и …………. .
Ж. Аллотропные модификации кислорода: …………….
2. Исправь ошибку и запиши правильно уравнения
Na + O = Na2O
S + F2 = SF6
Fe + S2 = FeS
P + O2 = PO5
S + Cl2 = SCl2
S + H2O = H2S + O2
3. Определите степень окисления и валентность серы в соединениях: сульфид кальция, сульфит кальция, сульфат кальция.
4. Вычислите массовые доли серы и хлора в соединении серы с хлором SCl4.
5. Какой объем оксида серы (IV) образуется при сжигании серы в 10 л воздуха?
Тест по теме: «Кислород и сера – элементы VIА группы»
1. Заполните пробелы в утверждениях:
А. Кислород и сера - элементы ……. . группы ………. . подгруппы.
Б. Заряд ядра атома кислорода равен …….
В. В ядре атома кислорода содержится …… протонов, …… нейтронов, …. . электронов.
Г. Атомы кислорода и серы имеют на внешнем уровне …. . электронов.
Д. Кислород имеет степень окисления в соединениях ……. и является в ходе химической реакции …………. .
Е. Сера имеет степени окисления в соединениях …………… и является в ходе химической реакции и окислителем, и …………. .
Ж. Аллотропные модификации кислорода: …………….
2. Исправь ошибку и запиши правильно уравнения
Na + O = Na2O
S + F2 = SF6
Fe + S2 = FeS
P + O2 = PO5
S + Cl2 = SCl2
S + H2O = H2S + O2
3. Определите степень окисления и валентность серы в соединениях: сульфид кальция, сульфит кальция, сульфат кальция.
4. Вычислите массовые доли серы и хлора в соединении серы с хлором SCl4.
5. Какой объем оксида серы (IV) образуется при сжигании серы в 10 л воздуха?
Особенности электронного строения атома углерода. Понятие о гибридизации атомных орбиталей. Химическая связь в органических соединений.
План урока:
1. Понятие о гибридизации атомных орбиталей.
2. Особенности электронного строения атома углерода.
3. Химическая связь в органических соединений.
Гибридизация атомных орбиталей – смешивание атомных ориталей (электронных облаков)различного типа (например, s- и р- орбиталей), в результате которого образуются одинаковые по форме и энергии гибридные орбитали.
Виды гибридизации атомных орбиталей:
А) sр1 (смешение одной s- и одной р- орбиталей): для веществ с одинарным (сигма) связями. ПРИМЕР: алканы
Б) sр2(смешение одной s- и двух р- орбиталей): для веществ с двойными связями. ПРИМЕР: алкены
В) sр3(смешение одной s- и трех р- орбиталей): для веществ с тройными связями. ПРИМЕР: алкины.
Валентность элемента определяется числом неспаренных электронов в атоме.
Число неспаренных электронов может увеличиваться в результате перехода атомов из основного состояния в возбужденное состояние.
Возбужденное состояние атома- это состояние с более высокой энергией, чем основное.
Возбуждение атома – процесс перехода атома из основного в возбужденное состояние (или разъединение спаренных электронов и переход одного из них с данного подуровня на основную орбиталь другого подуровня. В ПРЕДЕЛАХ ОДНОГО ЭНЕРГЕТИЧЕСКОГО УРОВНЯ.
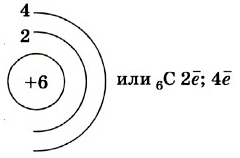 1s22s22p2.
1s22s22p2.
Домашняя работа:
1. При нагревании соли массой 25,6 г образовалась вода массой 14,4 г и азот объемом (н.у.) 8,96 дм3. Установите формулу соли, если ее молекулярная масса равна 64 г/моль.
2. Напишите электронные и структурные формулы молекул хлора и йода. Покажите с помощью электронно- графических схем образование ковалентной связи в двух молекулах.
Галогены в природе. Биологическое значение и применение галогенов и их соединений.
План урока: 1)Распространенность галогенов в природе;
2) Биологическое значение галогенов
3) Применение галогенов.
Задание 1. Отгадайте загадки. Ответы запишите в тетрадь.(Максимум 5 баллов)
| 1 балл | 2 балла | 3 балла |
Задание 2. Отгадайте кроссворд (Количество баллов = количество отгаданных слов. Максимум 8 баллов)
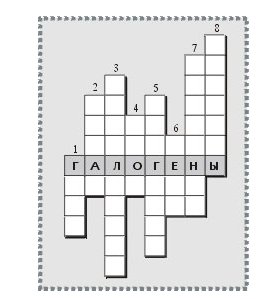
По вертикали: 1. Агрегатное состояние первых двух представителей галогенов при нормальных условиях. 2. Самый тяжелый галоген, полученный искусственно в 1940 г. с помощью ядерной реакции. Обнаружен в природе в 1943 г. По свойствам близок к йоду. 3. Наиболее характерное свойство галогенов – присоединение электрона, отдаваемого металлами. Поэтому о них говорят: «Галогены – сильные...» 4. Самый химически активный галоген. Впервые получен в 1886 г. А.Муассаном (Франция). 5. Переход из твердого состояния непосредственно в пар, способный превращаться в твердое тело, минуя стадию жидкого состояния. Легко осуществляется для йода. Используется для очистки веществ. 6. Количество электронов на внешнем энергетическом уровне в атомах галогенов. 7. Значение слова «бром» в переводе с греческого языка на русский. 8. Название солей, которые получаются в результате взаимодействия хлора с металлами; соли хлороводородной кислоты.
Задание 3. Используя данные параграфа заполните таблицу: (Максимум 10 баллов)
| Название соединения | Формула | Значение относительной молекулярной массы | Массовая доля галогена в соединении |
Задание 4. Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения (Максимум 20 баллов):
Вариант 1: КСl –Сl2 –Вr2 –НВr - Са Вr2
Вариант 2:NaJ – J2 –НJ –СаJ2 - АgJ
Задание 5.( Максимум 30 баллов) Древняя мудрость гласит: « Чтобы познать человека, с ним нужно съесть пуд соли». За какой период времени съедят столько соли два человека, если в среднем в течение суток один человек употребляет соль массой около 10-15 г.








Электронные конфигурации атомов
1.Число электронов = заряд ядра = число протонов = порядковый (атомный) номер.
2.Электроны в зависимости от их энергии распределяются в атоме по энергетическим уровням и подуровням, каждый из которых состоит из определённого числа орбиталей.
3.Распределение электронов выражается с помощью электронных конфигураций атома. Например, у водорода, элемента с атомным номером 1, электронная конфигурация – 1s1 .
4.Правило 1. Распределение электронов в атоме, находящемся в основном (наиболее устойчивом) состоянии, определяется принципом минимума энергии: основному состоянию атома соответствуют наиболее низкие из возможных энергетические уровни и подуровни.
Правило 2. На каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
Правило 3. Оно устанавливает порядок заполнения орбиталей одного подуровня. Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два.
5.На внешнем электронном слое в атоме любого элемента может находиться не более 8 электронов.
Вопросы и задания:
1. Сколько подуровней может быть в каждом из энергетических уровней с n = 1, 2, 3, 4? Как обозначаются эти подуровни? Сколько электронов максимально может находиться на каждом подуровне и уровне?
2. В каком порядке орбитали заполняются электронами? Чем определяется этот порядок?
3. Составьте электронные схемы, а затем электронные конфигурации и электронно- графические схемы атомов: В, F, Аl, Si, Cl.
4. Сколько электронов находится на внешнем электронном слое атомов лития, углерода, магния, серы, аргона? Сколько из них спаренных и неспаренных?
5. Запишите полные электронные конфигурации, а затем изобразите электронно- графические схемы следующих атомов и ионов: F -, S 2-,C, Са2+ и К.
7. Рассчитайте содержание кальция, кислорода, углерода и водорода (в граммах, молях и массовых долях) в Ca(HCO3) 2 массой 32,4 г.
Количественные характеристики вещества ( 11 класс)
Вариант 1
Масса вешества химическим количеством 4 моль равна 64 кг.Чему равны его молярная и относительно молекулярна массы.
Определите химическое количество этана, в котором содержится 3,01*1023 молекул
Рассчитайте массы одной молекулы азота.
Запишите 6 формул: а) простых веществ (газов); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат железа (11), фосфат кальция, карбонат магния, оксид алюминия, гидроксид бария.
Одинаковое ли число молекул содержится в азоте и метане, которых одинаковые массы равные 2 кг
Количественные характеристики вещества ( 11 класс)
Вариант 2
Масса вешества химическим количеством 4 моль равна 64 кг. Чему равны его молярная и относительно молекулярна массы.
Определите объем этана, в котором содержится 6,02*1023 молекул
Рассчитайте массы одной молекулы кислорода.
Запишите 6 формул: а) простых веществ (твердых); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат железа (!!!), хлорид кальция, карбонат алюминия, оксид водорода, гидроксид стронция.
Одинаковый ли объем занимают в сосуде азот и метан, если их массы равны 2 кг.
Количественные характеристики вещества ( 11 класс)
Вариант 3
Чему равны его молярная и относительно молекулярная массы воды, объем которой равен 23 см3
Определите объем этана, в котором содержится 3,01*1023 молекул
Рассчитайте массы одной молекулы водорода
Запишите 6 формул: а) простых веществ (твердых ); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат меди (11), фосфат калия, нитрат магния, оксид натрия, гидроксид бериллия.
Одинаковое ли число молекул содержится в азоте и пропане, которых одинаковые массы равные 2 кг
Количественные характеристики вещества ( 11 класс)
Вариант 4
Чему равны молярная и относительно молекулярная массы вещества, которое содержит 3,01*1023 молекул .
Определите массу этана химическим количеством 2 моль.
Рассчитайте массы одной молекулы хлора.
Запишите 6 формул: а) простых веществ (твердых); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат меди (!!), бромид кальция, сульфит алюминия, оксид бора, гидроксид стронция.
Одинаковый ли объем занимают в сосуде водород и метан, если их массы равны 2 кг
Количественные характеристики вещества ( 11 класс)
Вариант 5
Объем вешества химическим количеством 32моль.Чему равны его масса о объем, если известно , что данное вещество является газом.
Определите химическое количество этана, в котором содержится 3,01*1023 молекул
Рассчитайте массы одной молекулы фтора.
Запишите 6 формул: а) простых веществ (газов); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат железа (11), силикат кальция, нитрит магния, оксид лития, гидроксид магния.
Одинаковое ли число молекул содержится в хлоре и метане, которых одинаковые массы равные 2 кг
Количественные характеристики вещества ( 11 класс)
Вариант 6
Масса вешества химическим количеством 4 моль равна 164 кг. Чему равны его молярная и относительно молекулярна массы.
Определите объем этана, в котором содержится 12,04*1023 молекул
Рассчитайте массы одной молекулы хлора.
Запишите 6 формул: а) простых веществ (твердых); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфид железа (!!!), хлорид калия, карбонат лития, оксид магния, гидроксид кальция.
Одинаковый ли объем занимают в сосуде азот и пропен, если их массы равны 2 кг.
Количественные характеристики вещества ( 11 класс)
Вариант 7.
Чему равны его молярная и относительно молекулярная массы углекислого газа, масса которого равна 23 г.
Определите объем этена, в котором содержится 3,01*1023 молекул
Рассчитайте массы одной молекулы кислорода
Запишите 6 формул: а) простых веществ (твердых ); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат меди (11), фосфат рубидия, нитрит магния, оксид цинка, гидроксид алюминия.
Одинаковое ли число молекул содержится в водороде и пропене, которых одинаковые массы равные 2 кг
Количественные характеристики вещества ( 11 класс)
Вариант 8
Чему равны молярная и относительно молекулярная массы вещества, которое содержит 3,01*1023 молекул .
Определите массу бутана химическим количеством 2 моль.
Рассчитайте массы одной молекулы йода.
Запишите 6 формул: а) простых веществ (твердых); б) сложных веществ как молекулярного, так и немолекулярного строения.
Укажите формульные единицы: сульфат меди (!!), бромид кальция, сульфит алюминия, оксид бора, гидроксид стронция.
Одинаковый ли объем занимают в сосуде этен и метан, если их массы равны 2 кг
Состояние электрона в атоме; атомная орбиталь. Энергетиеский уровень и подуровень. S- и р- орбитали в атоме.
План урока:
Электронное облако- квантово- механическая модель, описывающая состояние электрона в атоме.
Двойственная природа электрона.
Атомная орбиталь (форма и размер) .
Энергетиеский уровень и подуровень. S- и р- орбитали в атоме.
1. В ходе химических реакций ядро атома остается постоянным, а электронное состояние атома изменяется.
2. электрон имеет двойственную природу: а) частица (имеет определенную массу, заряд); б) волна (нет траектории движения, точного местоположения в пространстве). Вывод: электрон обладает корпускулярными и волновыми свойствами.
3. Электронная плотность - места атома, где чаще всего он находится.
4. Электронное облако- совокупность всех электронов в атоме
5. Электронная орбиталь- область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона (90%). Отличаются по форме и по размеру:
А) шарообразные (характерны для s- электронов)
Б) гантели или «объемная восьмерка» (характерны для р- электронов)
В) d
Г) f
6. Графически орбиталь обозначается в виде клеточки ( квантовой ячейки), а электрон- в виде стрелочки. Например, орбиталь атома водорода:
7. Электрон движется вокруг ядра. Для него характерен собственный момент движения или вращение вокруг собственной оси (спин).
8. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины.
Спаренные электроны:
Неспаренные электроны:
9. Тем выше энергия электрона, тем дальше он находится от ядра и тем больше размер электронного облака (орбитали).
10. Энергетический уровень(электронный слой, электронная оболочка) – это совокупность электронов с близкими значениями энергий.
Число энергетических уровней (n) в атоме = номеру периода, в котором атом находится.
Число орбиталей (N) можно найти по формуле: N= n2, где n- число энергетических уровней.
11. Энергетический подуровень- совокупность орбиталей, которые находятся на одном энергетическом уровне и имею одинаковую форму.
Домашнее задание:
Природная медь представляет собой смесь нуклидов 63Си и 65Си. Доля первого в природной смеси равна 73%, второго – 27%. Вычислите относительную атомную массу меди.
Чему равен заряд ядра, число нейтронов и число электронов в атоме каждого из нуклидов:35 Сl, 40 К, 56Fе, 208 Рb.
Определите суммарное число протонов, нейтронов и электронов в фосфате кальция химическим количеством 0,05 моль.
Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
F +9 )2)7
Na +11 )2)8)1
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион)

Процесс отдачи электронов атомом, называется окислением.
- Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем.
- Процесс принятия электронов атомом, называется восстановлением.
- Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем.
Правила определения степени окисления атома в ПСХЭ Д.И. Менделеева:
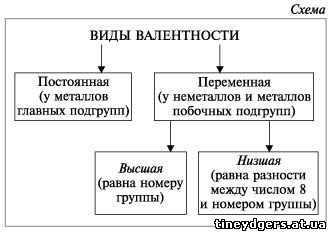
1. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me+nHn-1)
2. Кислород обычно проявляет СО -2 (исключения: О+2F2, H2O2-1 – перекись водорода)
3. Металлы проявляют только +n положительную СО
4. Фтор проявляет всегда СО равную -1 (F-1)
5. Для элементов главных подгрупп:
Высшая СО (+) = номеру группы Nгруппы
Низшая СО (-) = Nгруппы–8
Правила определения степени окисления атома в соединении:
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na0, P40, O20
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0, а в сложном ионе его заряду.
Например, H+1N+5O3-2 : (+1)*1+(+5)*1+(-2)*3 = 0
[S+6O4 -2]2-: (+6)*1+(-2)*4 = -2
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
1. Амфотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль
фотерный гидроксид+ кислота→ соль+ вода
2. Амфотерный гидроксид+щелочь →соль+ вода
3. Амфотерный оксид+ кислота→соль+ вода
4. Амфотерный оксид+ основание→соль+ вода
5. Амфотерный оксид+ кислотный оксид→соль
6. Амфотерный оксид+ основный оксид→соль






Первоначальные представления о валентности (7 класс)
Цели урока: опираясь на знания учащихся, повторить понятия “химическая формула”; способствовать формированию у учащихся понятия “валентность” и умению определять валентность атомов элементов по формулам веществ акцентировать внимание школьников на возможности интеграции курсов химии, математики.
Задачи: продолжить формирование умений формулировать определения; разъяснять смысл изученных понятий и объяснять последовательность действий при определении валентности по формуле вещества; способствовать обогащению словарного запаса, развитию эмоций, творческих способностей; развивать умение выделять главное, существенное, сравнивать, обобщать, развивать дикцию, речь; воспитывать чувство товарищества, умение работать коллективно; повысить уровень эстетического воспитания учащихся; ориентировать учащихся на здоровый образ жизни.
Ход урока
I. Оргмомент .
II. Проверка домашнего задания.
III. Изучение нового материала.
До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
Задание: сравните качественный и количественный состав в молекулах: HCl , H 2O, NH 3, CH4.
Беседа с учащимися: – Что общего в составе молекул? Предполагаемый ответ: Наличие атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
H2O – один атом кислорода удерживает два атома водорода,
NH3 – один атом азота удерживает три атома водорода,
CH4 – один атом углерода удерживает четыре атома водорода.
Проблема: Почему различные атомы удерживают различное количество атомов водорода?
Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами.
Валентность атома водорода принята за единицу, а у кислорода – II.
2. Эволюция понятия “валентность” (сообщение учащегося).
– В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
В конце 50-х гг. XIX вeка А.С. Купер и А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
3. Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента.
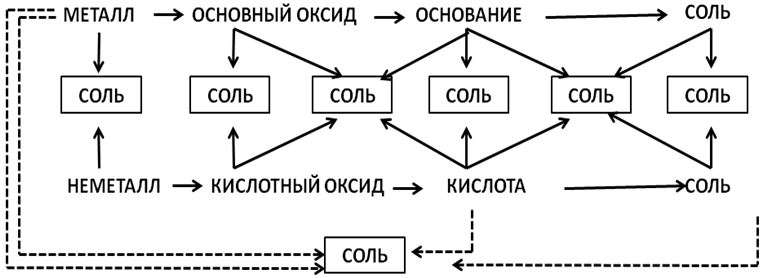
Алгоритм определения валентности
1. Написать символы элементов :В О
2. Определить валентности элементов:
3. Найти наименьшее общее кратное численных значений валентностей: 3•2 = 6
4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов:
5. Записать индексы при символах элементов
4. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске). SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
III. Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Задание в раздаточном материале.
Репродуктивный уровень (“3”). Определите валентность атомов химических элементов по формулам соединений: NH3, Au2O3, SiH4, CuO.
Прикладной уровень (“4”). Из приведённого ряда выпишите только те формулы, в которых атомы металлов двухвалентны: MnO, Fe2O3 , CrO3, CuO, K2O, СаH2.
Творческий уровень (“5”). Найдите закономерность в последовательности формул: N2O, NO, N2O3 и проставьте валентности над каждым элементом.
Проверка выборочная. Консультант из числа учащихся по готовому шаблону проверяет 4 тетради учащихся.
Урок : Относительная молекулярная и относительная формульная масса вещества (7 класс)
Цели урока: - повторение написания и произношения знаков химических элементов;
- рассмотреть понятие «химическая формула», «индекс»;
Задачи:
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u
Цели урока:
Закрепить полученные знания об одноатомных спиртах.
Познать новое (многоатомные спирты) в сравнении с одноатомными, найти в общем частное, в частном общее.
Задачи урока:
Способствовать развитию мобильности мышления через применение в конкретных ситуациях знаний из различных курсов органической химии.
Развивать умение участвовать в проблемном диалоге.
Содействовать развитию познавательного интереса учащихся.
Реактивы: растворы гидроксида меди (II), гидроксида натрия, глицерин, этиленгликоль, этанол, натрий, (р) соляной кислоты.
Оборудование: кодоскоп, модели молекул спиртов, пробирки, колба, таблица, сопоставляющая физические свойства одноатомных и многоатомных спиртов.
Тип урока: комбинированный.
План урока
1. Состав и классификация многоатомных спиртов.
2. Изомерия и номенклатура двух- и трёхатомных спиртов.
3. Физические свойства глицерина и этиленгликоля.
4. Химические свойства глицерина:
а) сходство с одноатомными спиртами,
б) качественная реакция на многоатомные спирты.
5. Получение глицерина и этиленгликоля.
6. Применение.
ХОД УРОКА
I. Организационный момент
Заранее на доске записывается тема, план урока и домашнее задание.
Учитель объявляет тему, сообщает цели и задачи урока.
Учащиеся записывают тему урока в тетради.
II. Актуализация знаний
Фронтальная беседа.
1. Какие вещества называются спиртами? (Спиртами называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.)
2. Как классифицируются одноатомные спирты по радикалу? (Спирты классифицируются на предельные, непредельные, ароматические.)
3. Какие вещества называются предельными одноатомными спиртами? (Производные предельных углеводородов, в молекулах которых один атом водорода замещен на гидроксильную группу.)
4. Перечислите названия первых пяти представителей гомологического ряда предельных одноатомных спиртов. (Метиловый, этиловый, пропиловый, бутиловый, амиловый;
метанол, этанол, пропанол, бутанол, пентанол.)
5. Назовите формулы этих спиртов. (СН3ОН, С2Н5ОН, С3Н7ОН, С4Н9ОН, С5Н11ОН).
6. Какие группы атомов называются функциональными? (Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ.)
Задание: среди моделей спиртов найдите модель этанола (учащиеся находят модель одноатомного спирта).
III. Изучение нового материала
Учитель. Оказывается, существуют ещё и другие спирты – многоатомные. Да, действительно, есть спирты, которые имеют две, три, шесть гидроксогрупп.
Задание: найдите модели спиртов, молекулы которых содержат две гидроксильные группы (учащиеся находят модель этиленгликоля). Это двухатомные спирты – диолы.
Трехатомные спирты имеют три гидроксогруппы – триолы. Известные спирты и большей атомности, например сорбит содержит шесть гидроксогрупп:
СН2ОН – СНОН – СНОН – СНОН – СНОН – СН2ОН.
По программе мы изучаем двух- и трехатомные спирты.
Формулы многоатомных спиртов, как и одноатомных, можно вывести из формул соответствующих углеводородов, заменяя в них атомы водорода гидроксильными группами.
Если, например, в формуле молекулы этана гидроксильными группами заместить два атома водорода (у каждого атома углерода по одному), то получится формула молекулы двухатомного спирта:
СН2ОН – СН2ОН этиленгликоль, по систематической номенклатуре этандиол – 1,2.
В названиях многоатомных спиртов перед суффиксом – ОЛ ставят числительное, указывающее количество гидроксогрупп.
Задание: из формулы молекулы пропана вывести формулу молекулы трехатомного спирта глицерина и дать название по систематической номенклатуре.
Ученик выполняет задание на доске, а учащиеся в тетрадях.
СН3 – СН2 – СН3 –– СН2 ОН – СНОН – СН2 ОН глицерин или пропантриол – 1, 2, 3.
Вывод: к названиям предельных углеводородов добавляем суффикс – триол, цифрами указываем положение гидроксогрупп.
Получить спирт, в котором хотя бы две гидроксильные группы находились при одном атоме углерода обычно не удается: такое соединение оказывается неустойчивым.
Учитель. При изучении какой кислоты мы встретились с неустойчивостью двух гидроксильных групп при одном атоме углерода?
Ученик: известно, что эта кислота угольная
с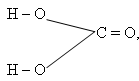 уществует только в растворе; при попытке выделить в чистом виде распадается на оксид углерода (IV) и воду.
уществует только в растворе; при попытке выделить в чистом виде распадается на оксид углерода (IV) и воду.
Изомерия трёхатомных спиртов и двухатомных (гликолей) зависит от строения цепи и положения в ней.
Учитель. Напишите формулы спиртов:
СН3 – СНОН – СН2ОН СН2ОН – СН2 – СН2ОН
пропандиол-1,2 и пропандиол-1,3
Ученик выполняет задание на доске, а учащиеся в тетради.
Физические свойства
Учитель. Ребята, перед вами пробирка с глицерином. Рассмотрите, что представляет собой это вещество.
Лабораторный опыт: растворимость глицерина в воде.
К одному мл воды в пробирке прилили равный объем глицерина и взболтали смесь. Затем добавили еще столько же глицерина. Что можно сказать о растворимости его в воде? Опишите свойства, которые вы наблюдаете.
Ученики записывают в тетрадях планируемый ответ.
Глицерин – бесцветная, сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде.
Учитель. Добавлю, что эти физические свойства присущи и другим многоатомным спиртам, в том числе и этиленгликолю. Надо помнить! Этиленгликоль очень ядовитое вещество!
Задание: сравните физические свойства многоатомных и одноатомных спиртов. С помощью кодоскопа эти сведения проецируем на доску.
| Спирты | Относительная молекулярная масса | Температура кипения | Плотность г/см3 |
| Этиловый | 46 | 78 | 0,79 |
| Этиленгликоль | 62 | 197 | 1,11 |
| Н-пропиловый | 60 | 97 | 0,80 |
| Глицерин | 92 | 290 | 1,26 |
Учитель. Подумайте о причине различия физических свойств одноатомных и многоатомных спиртов?
Каковы изменения в относительных молекулярных массах спиртов?
Каковы причины резкого различия температуры кипения?
Ответы учащихся. Изменения в относительной массе одноатомных и многоатомных спиртов незначительные.
Резкие изменения температуры кипения спиртов объясняются числом гидроксогрупп.
Следует вывод: число гидроксогрупп в спирте оказывает влияние на их физические свойства (за счет водородных связей).
Химические свойства.
Учитель. Какие химические свойства характерные для одноатомных спиртов?
Учащиеся перечисляют свойства: реакция горения, реакция замещения водорода гидроксогруппы на щелочной металл, реакция обмена всей гидроксогруппы на галоген (с галогеноводородными кислотами и другие).
Учитель. Запишите в тетрадях уравнения реакции взаимодействия:
Этилового спирта с натрием;
Этилового спирта с галогеноводородной кислотой.
Ученик выполняет записи этих уравнений на доске.
Учитель. Проблемный вопрос. А будут ли эти свойства характерны для многоатомных спиртов?
Чтобы ответить на это вопрос проведем демонстрационный эксперимент.
Взаимодействие этиленгликоля с натрием:
СН2ОН – СН2ОН + 2Nа = СН2ОNа – СН2ОNа + Н2 ![]() гликолят натрия.
гликолят натрия.
Взаимодействие глицерина с галогеноводородными кислотами: в пробирку налили соляной кислоты и добавили метиловый оранжевый. Далее прилили раствор глицерина до изменения окраски (происходит замещение гидроксогрупп).
СН2ОН – СНОН – СН2ОН + 3НСI = СН2ОСI – СНОСI – СН2ОСI + 3Н2О
трихлоргидрин
Вывод: как вещества, содержащие гидроксогруппы, многоатомные спирты имеют сходные свойства с одноатомными спиртами.
Учитель. Проблемный вопрос. Должно ли вызвать появление новых химических свойств увеличение числа гидроксогрупп в молекулах многоатомных спиртов?
Чтобы разрешить эту проблему проведем лабораторную работу:
1. К двум мл раствора щелочи в пробирке прибавьте несколько капель раствора сульфата меди (II). Что наблюдаете? Напишите уравнение реакции. Ученик записывает уравнение на доске, а учащиеся в тетрадях.
CuSO4 + 2 NаOH = Cu(OH)2![]() + Nа2 SO4
+ Nа2 SO4
Cu2+ + 2OH– = Cu(OH)2 ![]()
Наблюдали образование синего осадка гидроксида меди (II).
2. К образовавшемуся осадку гидроксида меди (II) прилейте глицерин и смесь встряхните. Какие изменения произошли?
Ученик. Осадок растворяется и образуется раствор ярко-синего цвета, глицерат меди (II).
Учитель. Это качественная реакция на многоатомные спирты.
Уравнение:
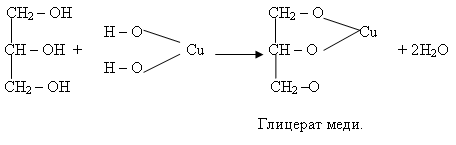
Уравнение дано в упрощенном виде, одновременно образуются и соединения более сложного состава.
Cu(OH)2 + 2СН2ОН – СНОН – СН2ОН ––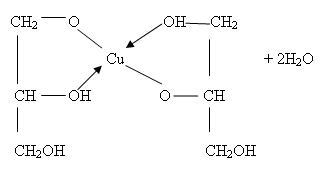
Глицерат меди (II).
Вывод: особенностью многоатомных спиртов является большая подвижность атомов водорода в гидроксогруппе и легкая окислительность радикала.
Причина: влияние этих групп друг на друга и на углеводородный радикал.
Ребята, на примере многоатомных спиртов мы убеждаемся в том, что количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного влияния появление у спиртов новых свойств по сравнению с одноатомными.
Получение многоатомных спиртов.
1. Подобно одноатомным спиртам, многоатомные спирты могут быть получены из соответствующих углеводородов через их галогенопроизводные:
СН2СI – СН2СI + 2Н2О ![]() СН2ОН – СН2ОН + 2НСI;
СН2ОН – СН2ОН + 2НСI;
2. При пропускании этилена через раствор перманганата калия:
СН2 = СН2 + [ О ] + Н2О –– СН2ОН – СН2ОН
Этиленгликоль
Учащиеся пишут уравнения самостоятельно, т.к. знакомы с ними.
3. Гидратация оксида этилена:
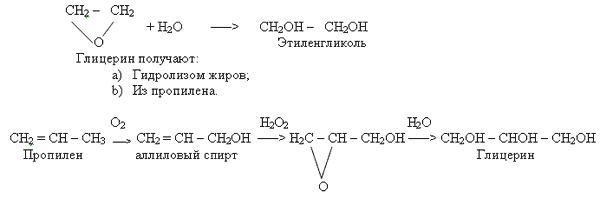
Применение.
Рассмотрим вопрос о применении.
Глицерин применяется для получения смазочных материалов, как умягчитель кожи и тканей, в парфюмерной фармацевтической и пищевой промышленности.
Водные растворы этиленгликоля и глицерина замерзают при низких температурах, поэтому их используют в качестве антифризов – жидкостей с низкой температурой замерзания, применяемых для охлаждения двигателей внутреннего сгорания.
Закрепление материала
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения: ![]()
Назовите вещества X, Y и Z.
Заключение
Подведение итогов, анализ работы на уроке, выставление оценок.