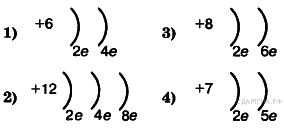Спецификация
контрольных измерительных материалов для проведения итоговой аттестации (в новой форме) по ХИМИИ обучающихся 8 класса по основным общеобразовательным программам основного общего образования
1. Назначение КИМ для промежуточной аттестации учащихся 8 класса.
Контрольные измерительные материалы призваны оценить подготовку по химии учащихся 8 класса по основным темам:
Первоначальные химические понятия
Основные классы неорганических соединений.
Периодический закон и периодическая система химических элементов Д.И. Менднлеева.
Химическая связь
Галогены.
КИМы позволяют оценить уровень знаний за курс 8 класса.
2. Документы, определяющие содержание КИМ
Содержание КИМ определяется на основе Федерального компонента государственного образовательного стандарта основного общего образования по химии (приказ Минобразования России от 05.03.2004 № 1089).
3. Подходы к разработке контрольных измерительных материалов по химии
Разработка КИМ по химии осуществлялась с учетом следующих общих положений.
КИМ ориентированы на проверку усвоения системы знаний, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для основной школы. В государственном стандарте основного общего образования по химии эта система знаний представлена в виде требований к подготовке выпускников.
КИМ призваны обеспечивать возможность дифференцированной оценки подготовки учащихся. В этих целях проверки усвоения основных элементов содержания курса химии осуществляется на трех уровнях сложности: базовом, повышенном и высоком.
Учебный материал, на базе которого строятся задания, отбирается по признаку его значимости для общеобразовательной подготовки учащихся 8 класса.
Характеристика структуры работы.
Каждый вариант экзаменационной работы состоит из 3 частей. Одинаковые по форме представления и уровню сложности задания сгруппированы в определенной части работы.
Часть 1 содержит 15 заданий с выбором ответа (базового уровня сложности). Их обозначение в работе: А1, А2, А3, … А15.
Часть 2 содержит 4 задания с кратким ответом (повышенного уровня сложности). Их обозначение в работе: В1, В2, В3, В4.
Часть 3 содержит 3 или 4 задания с развернутым ответом (высокого уровня сложности). Их обозначения в работе: С1–С3.
Задания расположены по принципу постепенного нарастания уровня их сложности. Доля заданий базового, повышенного и высокого уровней сложности составила в работе 68, 18 и 14% соответственно.
Общее представление о количестве заданий в каждой из частей экзаменационной работы моделей 1 и 2 дает таблица 1.
| № | Части работы | Количество заданий | Максимальный первичный балл | Тип заданий |
| 1 | Часть 1 | 15 | 15 | Задания с выбором ответа |
| 2 | Часть 2 | 4 | 8 | Задания с кратким ответом |
| 3 | Часть 3 | 3 | 11 | Задания с развернутым ответом |
|
| ИТОГО | 22 | 34 |
|
5. Характеристика содержания КИМ
Каждая группа заданий работы имеет свое предназначение.
Задания с выбором ответа проверяют на базовом уровне усвоение значительного количества элементов содержания курса химии VIII класса: знание языка науки, основных химических понятий, общих свойств классов неорганических; знание признаков классификации элементов, неорганических веществ, химических реакций и др.
В работе представлены две разновидности заданий с выбором ответа. В заданиях одного вида учащимся для выполнения задания необходимо выбрать один из четырех предложенных вариантов ответа. В заданиях другого вида предложены два суждения, верность которых следует оценить. Различие этих разновидностей заданий состоит в алгоритмах поиска правильных ответов.
Задания с кратким ответом проверяют на повышенном уровне наряду с элементами содержания, проверяемыми заданиями с выбором ответа, усвоение следующего учебного материала: химические свойства изученных классов неорганических веществ, классификация веществ и химических реакций.
В работе предложены два задания на выбор нескольких правильных ответов из предложенного перечня (множественный выбор) и два задания на установление соответствия позиций, представленных в двух множествах. Правильный ответ записывается в виде последовательности цифр. Выполнение заданий данного вида предусматривает осуществление многочисленных учебных действий (операций). Например, необходимо определить, с какими реагентами будет взаимодействовать то или иное вещество; определить реактив, который можно использовать для распознавания двух веществ.
Задания с развернутым ответом наиболее сложные в экзаменационной работе. Эти задания проверяют усвоение следующих элементов содержания: способы получения и химические свойства различных классов неорганических соединений, взаимосвязь веществ различных классов, количество вещества, молярный объем и молярная масса вещества, массовая доля растворенного вещества. Выполнение заданий этого вида предполагает сформированность комплексных умений:
– составлять уравнения химических реакции;
– объяснять обусловленность свойств и способов получения веществ их составом и строением, взаимосвязь неорганических веществ;
– проводить комбинированные расчеты по химическим уравнениям.
При выполнении первого задания необходимо на основании схемы реакции, представленной в его условии, составить уравнение реакции, указать её тип и определить классы веществ, участвующих в этой реакции.
Второе задание предполагает выполнение двух видов расчетов:
вычисление массовой доли растворенного вещества в растворе и вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции.
Третье задание (С3) является практико-ориентированным и имеет характер «мысленного эксперимента». Оно ориентировано на проверку следующих умений: планировать проведение эксперимента на основе предложенных веществ; описывать признаки протекания химических реакций, которые следует осуществить.
6. Распределение заданий КИМ по содержанию, видам проверяемых
умений и способам действий
При определении количества проверочных заданий работы, ориентированных на проверку усвоения учебного материала отдельных содержательных блоков, учитывалось, какой объем каждый из них занимает в курсе химии. Например, было принято во внимание, что в системе знаний, определяющих уровень подготовки учащихся 8 класса основной школы по химии, наиболее значительным является блок «Первоначальные химические понятия. Представления об неорганических веществах».
Распределение заданий представлено в таблице №2.
Таблица 2. Распределение заданий контрольной работы по видам проверяемых умений и способам действий
| Проверяемые умения и виды деятельности | Количество заданий | Максимальный первичный балл | Процент максимального первичного балла за задания данного вида учебной деятельности от максимального первичного балла за всю работу |
Называть: 1.1 вещества по их химическим формулам 1.2 типы химических реакций
| 2 | 2 | 5,9 |
Составлять: 2.1 формулы важнейших неорганических соединений изученных классов. 2.2 схемы, строения атомов первых 20 элементов Периодической системы Д.И. Менделеева 2.3 уравнения химических реакций. | 3 | 5 | 14,7 |
Характеризовать: 3.1 химические элементы (от водорода до кальция) на основе их положения в Периодической системе Д.И. Менделеева и особенностей строения их атомов; 3.2 химические свойства веществ – представителей различных классов неорганических соединений. | 6 | 7 | 20,6 |
Объяснять: 4.1 физический смысл порядкового номера химического элемента, номеров группы (для элементов главных подгрупп) и периода в Периодической системе, к которым принадлежит элемент; 4.2 закономерности в изменении свойств химических элементов и их соединений; 4.3 сущность химических реакций (окислительно- восстановительных и ионного обмена); 4.4 взаимосвязь веществ | 5 | 10 | 29,4 |
Определять: 5.1 принадлежность веществ к определенному классу 5.2 тип химической реакции по известным классификационным признакам 5.3 вид химической связи и степень окисления элементов. | 3 | 3 | 8,8 |
Проводить: 6.1 опыты, подтверждающие химические свойства изученных классов неорганических веществ опыты по получению, собиранию и изучению свойств неорганических веществ | 1 | 3 | 8,8 |
Вычислять: 6.1 массовую долю химического элемента в веществе. 6.2 массовую долю растворенного вещества в растворе. 6.3 количество вещества, массу вещества, объем по количеству, массе или объему реагентов или продуктов реакции | 2 | 4 | 11,8 |
| Итого: | 22 | 34 | 100 |
7. Распределение заданий КИМ по уровню сложности
В контрольную работу включены задания различных уровней
сложности: базового – Б; повышенного – П; высокого – В (таблица 3).
Распределение заданий экзаменационной работы по уровням сложности приводится в таблице 3.
Таблица 3. Распределение заданий экзаменационной работы по уровню сложности
| Уровень сложности | Количество заданий | Максимальный первичный балл | Процент максимального первичного балла за задания данного уровня сложности от максимального первичного балла за всю работу, равного 34 |
| Базовый | 15 | 15 | 44,1 |
| Повышенный | 4 | 8 | 23,5 |
| Высокий | 3 | 11 | 32,4 |
| ИТОГО | 32 | 34 | 100 |
8. Продолжительность работы по химии На выполнение работы отводится 2 часа – 120 минут.
Примерное время, отводимое на выполнение отдельных заданий,
составляет:
1) для каждого задания части 1 – 2–3 минуты;
2) для каждого задания части 2 – 10 –12 минут;
3) для каждого задания части 3 – 15–20 минут.
9. Дополнительные материалы и оборудование
В аудитории во время выполнения работы у каждого экзаменующегося должны быть следующие материалы и оборудование:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
10. Система оценивания выполнения отдельных заданий и работы в целом
Верное выполнение каждого задания части 1 оценивается 1 баллом.
В части 2 каждое верно выполненное задание В1–В4 максимально оценивается 2 баллами.
Задания В1, В2 считаются выполненными верно, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются 0 баллов. Задания В3, В4 считаются выполненными верно, если правильно установлены три соответствия. Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом. Остальные варианты считаются неверным ответом и оцениваются 0 баллов.
Максимальная оценка за верно выполненное задание: за задания С1 и С2 – по 3 балла; за задание С3 – 5 баллов; задания с развернутым ответом могут быть выполнены учащимися разными способами.
Полученные учащимися баллы за выполнение всех заданий суммируются. Итоговая оценка определяется по 5-балльной шкале.
Шкала пересчета первичного балла за выполнение промежуточной работы в отметку по пятибалльной шкале
| Отметка по пятибалльной шкале | «2» | «3» | «4» | «5» |
| Общий балл | 0 - 8 | 9 - 17 | 18 - 26 | 27 - 34 |
Отметку «5» рекомендуется выставлять в том случае, если из общей суммы баллов, достаточной для получения этой отметки, учащийся набрал 5 и более баллов за выполнение заданий части 3.
11. Обобщенный план варианта КИМ для учащихся 8 класса по химии.
Обозначение заданий в работе и бланке ответов: А – задания с выбором ответа; В – задания с кратким ответом; С – задания с развернутым ответом.
Уровни сложности задания: Б – базовый (примерный интервал выполнения –60–90%); П – повышенный (40–60%); В – высокий (менее 40%).
| № | Обозначение задания в работе | Проверяемые элементы содержания | Коды проверяемых элементов содержания (кодификатор ГИА 9) | Коды проверяемых умений (табл.2) | Уровни сложности задания | Максимальный балл за выполнение задания | Примерное время выполнения задания (мин.) |
-
| А1 | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д. И. Менделеева | 1.1 | 2.5.1 | Б | 1 | 3 |
-
| А2 | Периодический закон и Периодическая система химических элементов Д. И. Менделеева | 1.2 | 1.3 2.2.2 | Б | 1 | 3 |
-
| А3 | Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая | 1.3 | 2.4.3 | Б | 1 | 3 |
-
| А4 | Валентность химических элементов. Степень окисления химических элементов | 1.4 | 2.4.2 | Б | 1 | 3 |
-
| А5 | Простые и сложные вещества. Основные классы неорганических веществ | 1.6 | 2.1.2 2.4.4 | Б | 1 | 3 |
-
| А6 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения | 2.1 2.2 | 2.4.5 2.5.3 | Б | 1 | 3 |
-
| А7 | Номенклатура неорганических веществ | 1.6 | 1.1 | Б | 1 | 3 |
-
| А8 | Химическая реакция. | 2.1 | 2.2 | Б | 1 | 3 |
-
| А9 | Химические свойства простых веществ: металлов и неметаллов | 3.1 | 2.2.2 2.3.2 | Б | 1 | 3 |
-
| А10 | Химические свойства оксидов: основных, амфотерных, кислотных | 3.2.1 | 2.3.3 | Б | 1 | 3 |
-
| А11 | Химические свойства оснований. Химические свойства кислот | 3.2.2 3.2.3 | 2.3.2 | Б | 1 | 3 |
-
| А12 | Химические свойства солей (средних) | 3.2.4 | 2.3.3 | Б | 1 | 3 |
-
| А13 | Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование | 3.2.2 | 2.9 | Б | 1 | 3 |
-
| А14 | Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония) | 4.2 4.3 | 2.7.4 | Б | 1 | 3 |
-
| А15 | Вычисление массовой доли химического элемента в веществе | 4.5.1 | 2.8.1 | Б | 1 | 3 |
-
| В1 | Периодический закон Д. И. Менделеева. Закономерности изменения свойств элементов и их соединений в связи с положением в периодической системе химических элементов | 1.2.2 | 2.2.2 2.3.1 | П | 2 | 7 |
-
| В2 | Химические свойства простых веществ. | 3.1.2 | 3.1 | П | 2 | 8 |
-
| В3 | Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции | 1.6 | 4.1 | П | 2 | 8 |
-
| В4 | Химические свойства сложных веществ | 3.2 | 3.1 | П | 2 | 8 |
-
| С1 | Взаимосвязь различных классов неорганических веществ. | 3.1 3.2 3.3 4.4 | 2.4.6 2.5.3 | В | 3 | 12 |
-
| С2 | Вычисление массовой доли растворенного вещества в растворе | 4.5.2; 4.5.3 | 2.8.2 2.8.3 | В | 3 | 15 |
-
| С3 | Химические свойства простых веществ. Химические свойства сложных веществ. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония) | 3.3 | 4.2 | В | 5 | 15 |
| Всего заданий 22; из них по типу заданий: А-15, В-4, С-3; по уровню сложности: Б-15, П-4, В-3 Общее время выполнения работы – 120 минут |
Контрольная работа для итоговой аттестации учащихся 8 класса.
ВАРИАНТ 1
Часть А
При выполнении заданий в бланке ответов под номером выполняемого вами задания (А1–А15) поставьте крестик (х) в клеточку, номер которой соответствует выбранному вами ответу.
А1. Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
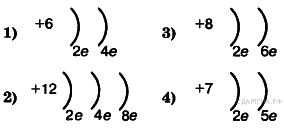
А2. Номер группы в Периодической системе химических элементов Д. И. Менделеева соответствует
1) числу электронов в атоме
2) значению высшей валентности элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) числу электронных слоев в атоме
А3. Ковалентная неполярная связь реализуется в веществе
1) H2S
2) S8
3) Na
4) CuO
А4.В каком соединении хлор проявляет высшую возможную степень окисления?
HCl
KClO
Cl2O7
KClO3
А5. Даны вещества: сера, белый фосфор и азотная кислота. Среди них к простым веществам относится(-ятся)
только сера
только белый фосфор;
белый фосфор и азотная кислота;
сера и белый фосфор
-
А6. . Реакция обмена с участием оксида кальция:
1) 
2) 
3) 
4) 
А7. Формула сульфата натрия:
1) Na2SO4
2) Na2S
3) Na2SO3
4) Na2SiO3
-
А8. Признаком протекания химической реакции между оксидом меди и водородом является
1) появление запаха
2) изменение цвета
3) выпадение осадка
4) выделение газа
А9. И железо, и фосфор реагируют с
водородом
хлором
щелочами
соляной кислотой
-
А10. С оксидом углерода(IV) взаимодействует каждое из двух веществ:




-
А11. Раствор серной кислоты реагирует с раствором
1) 
2) 
3) 
4) 
А12. Сульфат меди в водном растворе не реагирует с
1) 
2) 
3) 
4) 
А13. Верны ли суждения о правилах применения и хранения препаратов бытовой химии?
А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных.
Б. Растворители и моющие средства допускается хранить в доступных для детей местах.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А14. Собирать методом вытеснения воды, как это показано на рисунке, можно
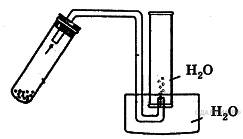
хлороводород
метан
оксид серы(IV)
аммиак
-
А15. На какой диаграмме правильно показаны массовые доли элементов в  ?
?

-
1
2
3
4
Часть В
Ответом к заданиям этой части (В1 – В4) является последовательность букв или цифр. Впишите ответы в бланк справа от номера соответствующего задания.
В1. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Среди перечисленных химических элементов 
1) наименьший радиус имеют атомы брома
2) наибольшую электроотрицательность имеет фтор
3) наиболее выраженные неметаллические свойства проявляет бром
4) высшую степень окисления +7 имеют хлор и бром
5) водородное соединение состава НЭ образует только фтор
-
В2. В реакцию с водородом вступают:
1) медь 4) магний
2) оксид меди (II) 5) хлорид бария
3) гидроксид натрия 6) оксид железа (III)
В3. Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ |
A)  | 1)  |
Б)  | 2)  |
B) | 3)  |
-
| 4)  |
-
| 5)  |
В4. Установите соответствие между формулой вещества и реагентами, с которыми это вещество может взаимодействовать.
ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
A)  | 1) |
Б)  | 2) (р-р) |
B) (р-р) | 3)  |
-
| 4) |
-
| -
|
-
Часть С
Подробное решение запишите на бланке №2.
С1. Дана схема превращений:
-
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
С2. К раствору сульфита натрия массой 252 г и массовой долей 5% добавили избыток раствора соляной кислоты. Вычислите объем (н. у.) выделившегося газа.
C3. Два газа, один из которых легче воздуха, а другой — тяжелее, прореагировали между собой при нагревании. Образовался газ с резким запахом X, хорошо растворимый в воде. Раствор X в воде обладает кислотными свойствами. При добавлении к этому раствору карбоната натрия выделяется газ. Определите формулу газа X и назовите его. Составьте два уравнения проведённых реакций.