
O
H
O
O
Na
O
+ 2NaOH
S
S
– 2 H 2 O
O
O
Na
O
H
O
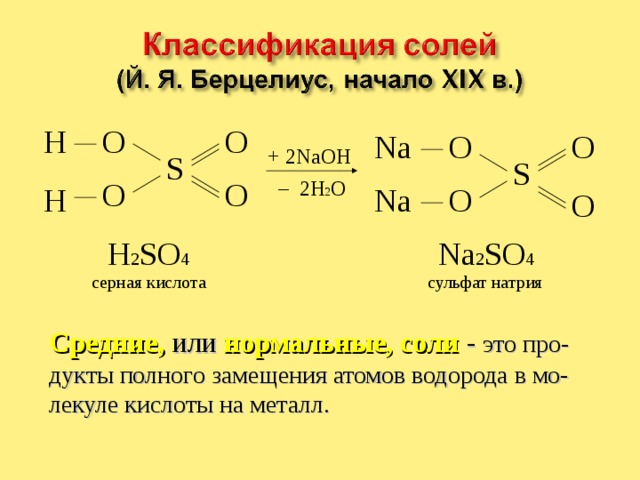
H 2 SO 4
Na 2 SO 4
серная кислота
сульфат натрия
Средние, или нормальные, соли - это про-дукты полного замещения атомов водорода в мо-лекуле кислоты на металл.
O
H
O
O
Na
O
+ NaOH
S
S
– H 2 O
O
O
H
O
H
O
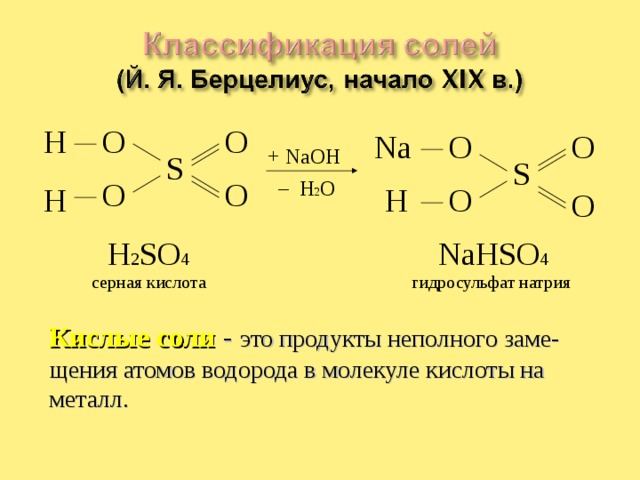
H 2 SO 4
NaHSO 4
серная кислота
гидросульфат натрия
Кислые соли - это продукты неполного заме-щения атомов водорода в молекуле кислоты на металл.
HO
NO 3
+ HNO 3
Ca
Ca
– H 2 O
HO
HO
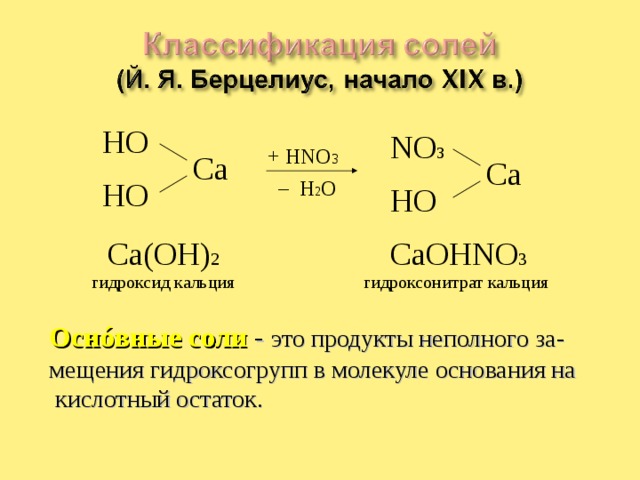
Ca(OH) 2
CaOHNO 3
гидроксид кальция
гидроксонитрат кальция
Осн ó вные соли - это продукты неполного за-мещения гидроксогрупп в молекуле основания на кислотный остаток.
соли
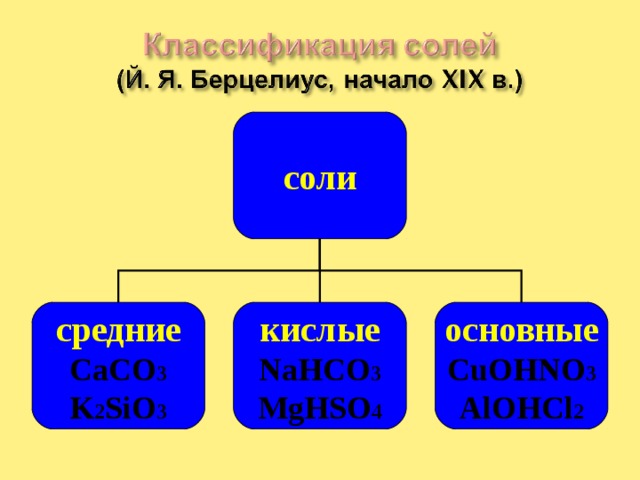
средние
кислые
основные
CaCO 3
K 2 SiO 3
NaHCO 3
MgHSO 4
CuOHNO 3
AlOHCl 2


1. Узнавание
Выберите из предложенного перечня только
те вещества, которые относятся к классу
солей:
KCl, Na 2 HPO 4 , NaOH, NaHSO 4 , HCl, MgSO 4 , NaH 2 PO 4 , Cu(OH) 2 , KNO 3 , NaNO 3 , Ca(NO 3 ) 2 , H 2 Cr 2 O 7 ; Na 2 MnO 4 ; HNO 3 ; Fe(NO 3 ) 2 ; NH 4 H 2 PO 4 ; (NH 4 ) 2 SO 4 , Ca(OH) 2 , NH 4 C1 , CaOHNO 3
- Чем вы руководствовались при выборе солей?
- Чем отличаются эти соли?
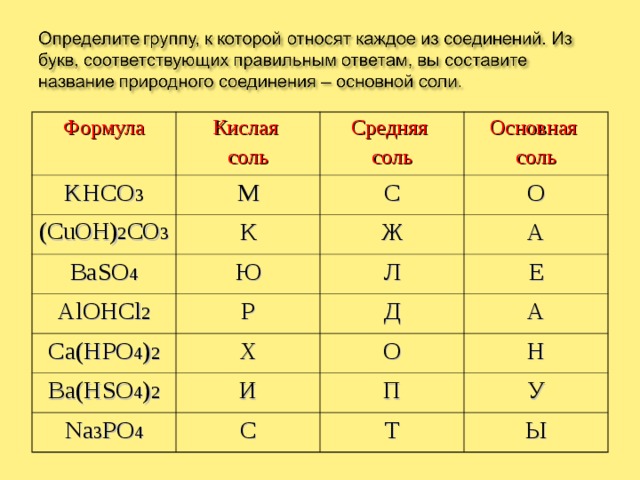
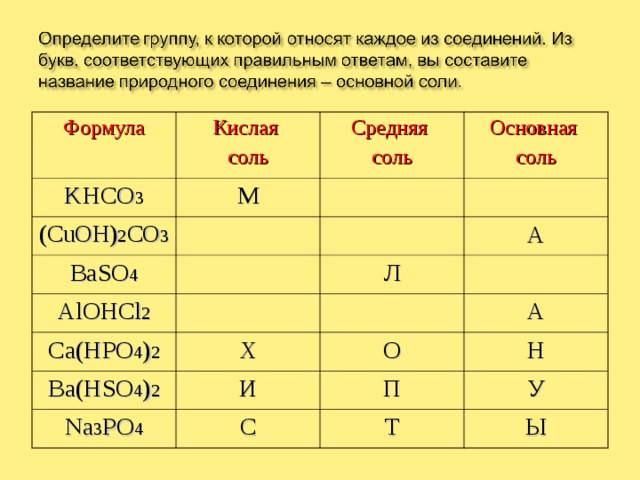
Формула
Кислая
соль
KHCO 3
М
(CuOH) 2 CO 3
Средняя
соль
BaSO 4
К
С
Основная
соль
О
Ю
Ж
AlOHCl 2
Ca(HPO 4 ) 2
А
Л
Р
Х
Е
Д
Ba(HSO 4 ) 2
А
О
И
Na 3 PO 4
Н
С
П
У
Т
Ы
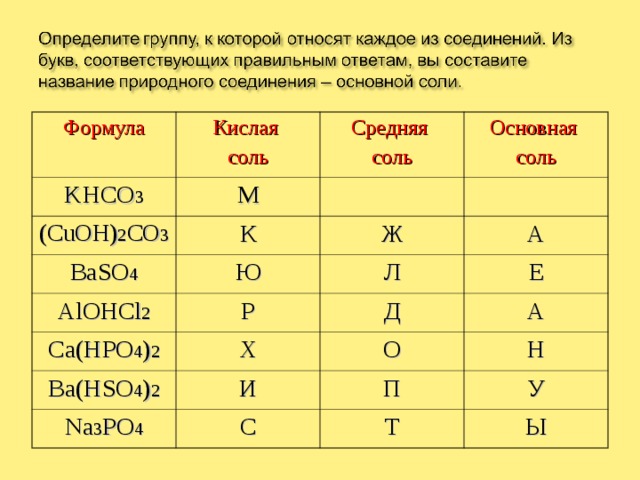
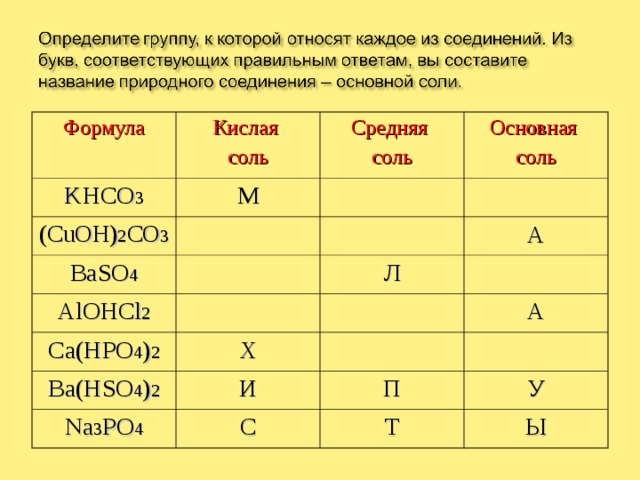
Формула
Кислая
соль
KHCO 3
М
Средняя
соль
(CuOH) 2 CO 3
BaSO 4
Основная
соль
К
Ю
AlOHCl 2
Ж
А
Р
Ca(HPO 4 ) 2
Л
Е
Х
Ba(HSO 4 ) 2
Д
Na 3 PO 4
И
О
А
Н
С
П
У
Т
Ы
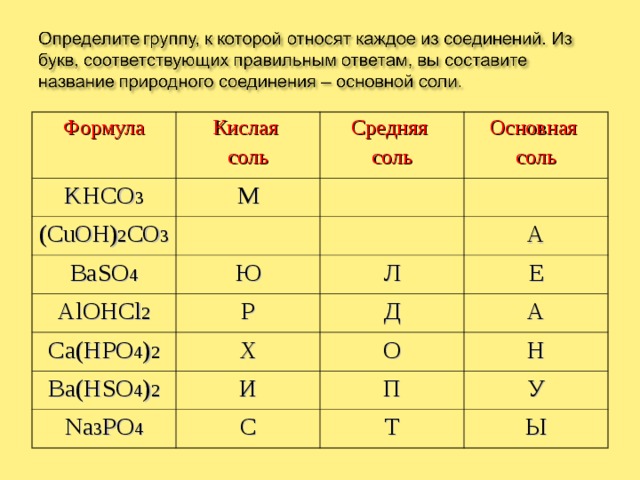
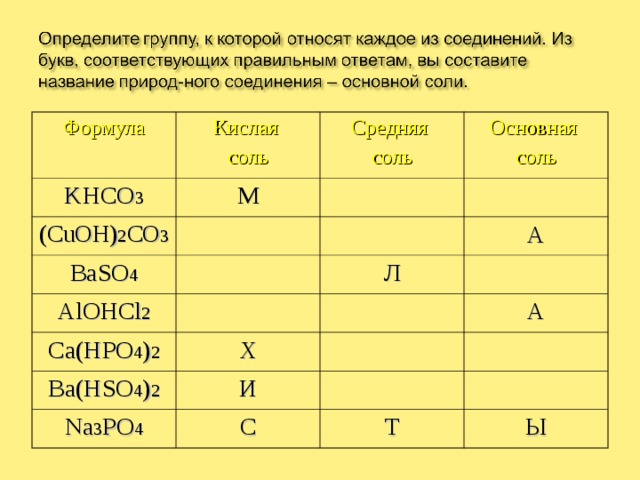
Формула
Кислая
соль
KHCO 3
М
Средняя
соль
(CuOH) 2 CO 3
Основная
соль
BaSO 4
Ю
AlOHCl 2
Ca(HPO 4 ) 2
Р
Л
А
Е
Х
Д
Ba(HSO 4 ) 2
А
О
И
Na 3 PO 4
Н
С
П
У
Т
Ы
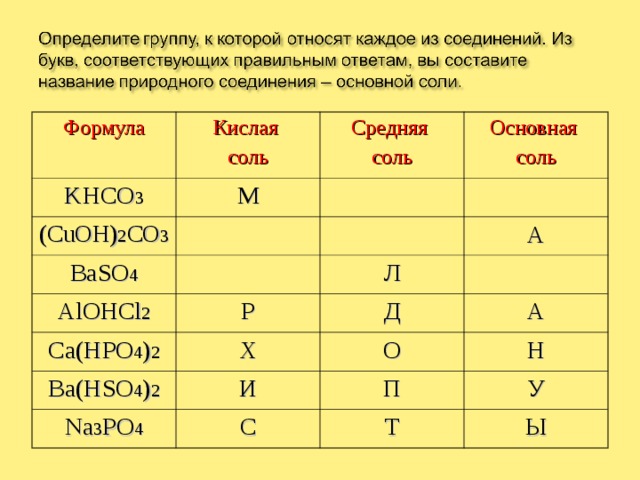
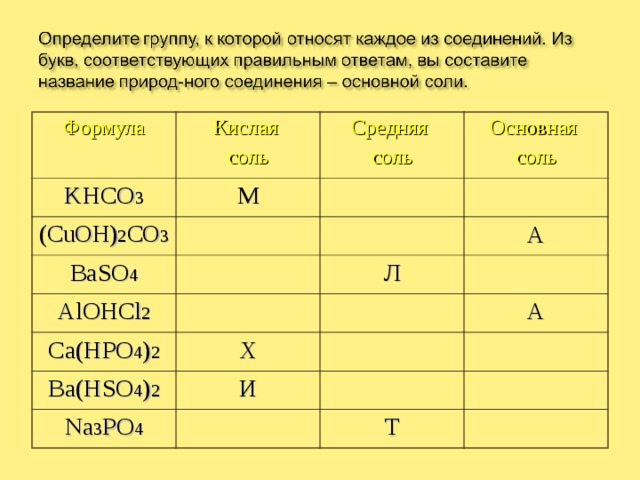
Формула
Кислая
соль
KHCO 3
М
Средняя
соль
(CuOH) 2 CO 3
Основная
соль
BaSO 4
AlOHCl 2
А
Л
Р
Ca(HPO 4 ) 2
Х
Ba(HSO 4 ) 2
Д
О
А
И
Na 3 PO 4
Н
С
П
У
Т
Ы
Формула
Кислая
соль
KHCO 3
М
Средняя
соль
(CuOH) 2 CO 3
Основная
соль
BaSO 4
AlOHCl 2
Ca(HPO 4 ) 2
А
Л
Х
Ba(HSO 4 ) 2
Na 3 PO 4
И
А
О
Н
С
П
У
Т
Ы
Формула
Кислая
соль
KHCO 3
М
Средняя
соль
(CuOH) 2 CO 3
BaSO 4
Основная
соль
AlOHCl 2
Л
А
Ca(HPO 4 ) 2
Х
Ba(HSO 4 ) 2
А
И
Na 3 PO 4
С
П
У
Т
Ы
Формула
Кислая
соль
KHCO 3
М
Средняя
соль
(CuOH) 2 CO 3
Основная
соль
BaSO 4
AlOHCl 2
Ca(HPO 4 ) 2
Л
А
Х
Ba(HSO 4 ) 2
А
И
Na 3 PO 4
С
Т
Ы
Формула
Кислая
соль
KHCO 3
М
(CuOH) 2 CO 3
Средняя
соль
BaSO 4
Основная
соль
AlOHCl 2
А
Л
Ca(HPO 4 ) 2
Х
Ba(HSO 4 ) 2
А
И
Na 3 PO 4
Т

МАЛАХИТ
(CuOH) 2 CO 3

Установите соответствие
Формула Название
А. Li 2 CO 3 1. Гидроксонитрат магния
Б. Ca ( HSO 3 ) 2 2. Карбонат лития
В. CaSO 4 3. Сульфат кальция
Г. MgOHNO 3 4. Гидросульфит кальция
5. Дигидросульфат кальция
6.Гидросульфат кальция

гидросульфат алюминия
AI(HSO 4 ) 3
гидросульфат магния
Mg(HSO 4 ) 2
дигидрофосфат кальция
Ca(H 2 PO 4 ) 2
гидрофосфат калия
K 2 HPO 4
гидросульфид меди (11)
Cu(HS) 2

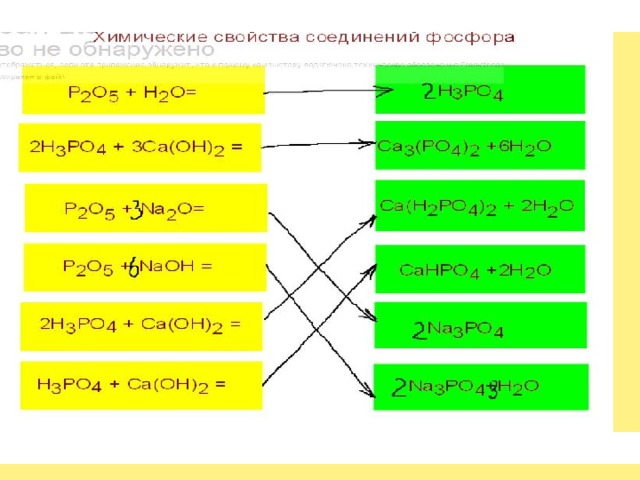
а) 1 моль ортофосфорной кислоты и 1 моль
щелочи. H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
б) 1 моль ортофосфорной кислоты и 2 моль щелочи
H 3 PO 4 + 2 NaOH = Na 2 HPO 4 +2 H 2 O
в) 1 моль ортофосфорной кислоты и 3 моль щелочи
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O

Для получения кислых солей кислота берётся в избытке, а основание в недостатке.

Элементы А, Б, С, Д образуют соединение состава АБСД 3 . Элемент А содержит в составе ядра атома 11 протонов. Элемент Б образует двухатомный газ с наименьшей молекулярной массой. Элемент С имеет два энергетических уровня, причем на внешнем уровне у него столько же электронов, сколько не хватает до завершения. Элемент Д входит в состав всех оксидов и с элементом С образует соединение СД 2 , широко используемого в процессе фотосинтеза.
Определите формулу соединения состава АБСД 3 . Укажите его систематическое название.

+ кислота
Средняя соль → кислая соль
←
+ щелочь
K 2 CO 3 + СО 2 + H 2 O = 2 KHCO 3
KHCO 3 + KOH = K 2 CO 3 + H 2 O
K 2 HPO 4 + H 3 PO 4 = 2KH 2 PO 4
2NaHSO 3 + 2KOH = Na 2 SO 3 + K 2 SO 3 +2H 2 O,
Ca(HCO 3 ) 2 + Ba(OH) 2 = BaCO 3 ↓ + CaCO 3 ↓ + 2H 2 O
Гидрокарбонаты разлагаются с образованием карбонатов при кипячении : 2КНСО 3 = К 2 СО 3 + Н 2 О + СО 2

Кислые соли проявляют свойства кислот, взаимодействуют с металлами, оксидами металлов, гидроксидами металлов, солями.
2KНSO 4 + Mg = H 2 + MgSO 4 + K 2 SO 4 ,
2KHSO 4 + MgO = H 2 O + MgSO 4 + K 2 SO 4 ,
2KHSO 4 + 2NaOH = 2H 2 O + K 2 SO 4 + Na 2 SO 4 ,
2KHSO 4 + Cu(OH) 2 = 2H 2 O + K 2 SO 4 + CuSO 4 ,
2KHSO 4 + MgCO 3 = H 2 O + CO 2 + K 2 SO 4 +MgSO 4 ,
2KHSO 4 + BaCl 2 = BaSO 4 + K 2 SO 4 + 2HCl.

H 2 O 2 моль NaOH H 3 PO 4 2моль KOH
0,5 моль P 2 O 5 → A → Б → В → Г+ Д
Запишем уравнения реакций:
P 2 O 5 + 3H 2 O → 2H 3 PO 4 ;
H 3 PO 4 + 2NaOH → Na 2 HPO 4 + 2H 2 O;
Na 2 HPO 4 + H 3 PO 4 → 2NaH 2 PO 4
2NaH 2 PO 4 + 2KOH → Na 2 HPO 4 + K 2 HPO 4 + 2H 2 O.
Найдем сумму молярных масс солей Г (Na2HPO4) и Д (K2HPO4):
M(Na2HPO4)+M(K2HPO4)=142+174=316 г/моль.
Ответ: 316.

H 2 SO 4 конц . избыток 1 моль Ca(OH) 2 1 моль H 3 PO 4 1 моль КОН
0,5 моль Ca 3 ( PO 4 ) 2 → А → Б → В → Г+ Д
Запишем уравнения реакций:
Ca3(PO4)2 + 3H2SO4 (конц.) → 2H3PO4 + 3CaSO4↓;
H3PO4 + Ca(OH)2 → CaHPO4↓+ 2H2O;
CaHPO4 + H3PO4 → Сa(H2PO4)2
Сa(H2PO4)2 + KOH → CaHPO4↓ + KH2PO4 + H2O.
Найдем сумму молярных масс солей Г (Ca3(PO4)2) и Д (K3PO4):
M(CaHPO4)+M(KH2PO4)=136+136=272 г/моль.
Ответ: 272.

всех возможных реакций.

Р е ш е н и е
2 NaOH + CO 2 = Na 2 CO 3 + H 2 O
2 моль 1 моль
NaOH + CO 2 = NaHCO 3
1 моль 1 моль
(NaOH) = m / M = 60 (г)/40 (г/моль) = 1,5 моль;
(СО 2 ) = V / V m = 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку (NaOH) : (CO 2 ) = 1,5 : 2 = 0,75 : 1, то делаем вывод, что СО 2 в избытке, следовательно, получится кислая соль:
NaOH + CO 2 = NaHCO 3 .
Количество вещества образовавшейся соли равно количеству вещества прореагировавшего гидроксида натрия:
(NaHCO 3 ) = 1,5 моль.
m (NaHCO 3 ) = M • = 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m (NaHCO 3 ) = 126 г.

З а д а ч а 2. Сероводород объемом 8,96 л пропустили через 340 г 2%-го раствора аммиака. Назовите соль, получившуюся в результате реакции, и определите ее массу.
Ответ : гидросульфид аммония, m (NH 4 HS) = 20,4 г.
З а д а ч а 3 . Газ, полученный при сжигании 3,36 л пропана, прореагировал с 400 мл 6%-го раствора гидроксида калия ( = 1,05 г/мл). Найти состав полученного раствора и массовую долю соли в полученном растворе.
Ответ: (KНСО 3 ) = 10,23 %.
З а д а ч а 4. Весь углекислый газ, полученный при сжигании 9,6 кг угля, пропустили через раствор, содержащий 29,6 кг гидроксида кальция. Найти массу полученной соли.
Ответ : m (Ca(HCO 3 ) 2 ) = 64,8 кг.
З а д а ч а 5. В 9,8 кг 20%-го раствора серной кислоты растворили 1,3 кг цинка. Найти массу полученной соли.
Ответ: m (ZnSO 4 ) = 3,22 кг.

Например, при нейтрализации оксида фосфора (V) щелочью в зависимости от молярного соотношения образуются следующие продукты:
P 2 O 5 + 6NaOH = 2Na 3 PO 4 + 3H 2 O (P 2 O 5 ) / (NaOH) = 1 / 6
P 2 O 5 + 4NaOH = 2Na 2 HPO 4 + H 2 O (P 2 O 5 ) / (NaOH) = 1 / 4
P 2 O 5 + 2NaOH + H 2 O = 2NaH 2 PO 4 (P 2 O 5 ) / (NaOH) = 1 / 2
Следует помнить, что при неполной нейтрализации образуются смеси двух соединений. Так, при взаимодействии 0,2 моль Р 2 О 5 с раствором щелочи, содержащим 0,9 моль NaOH, молярное соотношение находится между 1 / 4 и 1 / 6.
В этом случае образуется смесь двух солей: фосфата натрия и гидрофосфата натрия. Если раствор щелочи будет содержать 0,6 моль NaOH, то молярное соотношение будет другим: 0,2 / 0,6 = 1 / 3, оно находится между 1 / 2 и 1 / 4, поэтому получится смесь двух солей дигидрофосфата и гидрофосфата натрия.

1.
2.
3. х у
4. х у
5.

Р е ш е н и е
4Р + 5О 2 = 2Р 2 О 5
4 моль 2 моль
(P) = m / M = 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, (P 2 O 5 ) = 0,1 моль.
m (KOH) = • m (р-ра) = 0,084•200 (г) = 16,8 г,
(KOH) = m / M = 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
Р 2 О 5 + 6КОН = 3Н 2 О + 2К 3 РО 4
1 моль 6 моль х моль 4х моль
Р 2 О 5 + 4КОН = 2Н 2 О + 2К 2 НРО 4
1 моль 4 моль у моль 2у моль
Р 2 О 5 + 2КОН + Н 2 О = Н 2 О + 2КН 2 РО 4
1 моль 2 моль

(Р 2 О 5 ) (КОН) = 0,1 0,3 = 1 3 получится смесь двух солей –
гидрофосфата и дигидрофосфата калия.
Обозначим (Р 2 О 5 ) 2 = х моль, а (Р 2 О 5 ) 3 = у моль (КОН) 2 = 4х , (КОН) 3 = 2у
Составим систему уравнений:
х + у = 0,1 х = 0,1 – у
4х + 2у = 0,3 4(0,1 – у) + 2у = 0,3
0,4 – 4у + 2у = 0,32у = 0,1 у = 0,05
х = 0,1 – 0,05 = 0,05
( P 2 O 5 ) 2 = 0,05 моль (К 2 НРО 4 ) = 0,1 моль
(Р 2 О 5 ) 3 = 0,05 моль (КН 2 РО 4 ) = 0,1 моль
Ответ: (К2НРО4) = 0,1 моль, (КН2РО4) = 0,1 моль

2. Найти массы и массовые доли солей, полученных при растворении 22,4л углекислого газа в 480г 10 % - го раствора гидроксида натрия. Ответ: m ( Na 2 CO 3 ) = 21,2г, р.в.( Na 2 CO 3 ) = 4%, m ( NaHCO 3 ) =67,2г р.в.( NaHCO 3 ) = 13%
3. Найти массовые доли солей в растворе, полученном при пропускании 100 м 3 аммиака через 500 кг 50% - го раствора фосфорной кислоты. Ответ: р.в.((N H 4 ) 2 HPO 4 ) = 43,8%, р.в.( NH 4 H 2 PO 4 ) = 12,7%
4. К 50г раствора ортофосфорной кислоты с массовой долей 11,76% прибавили 150г раствора гидроксида калия с массовой долей 5,6%. Найти состав остатка, полученного при выпаривании раствора.
Ответ: m(K 3 PO 4 ) = 6,36г, m ( K 2 HPO 4 ) = 5,22г
5. Сожгли 5,6л бутана (н.у.), и образовавшийся углекислый газ пропустили через раствор, содержащий 102,6г гидроксида бария. Найти массы полученных солей.
Ответ: m( BaCO 3 ) = 39,4г , m ( BaHCO 3 ) = 103,6г



















































