Кальций и его соединения

Кто посоветовал: « Старайтесь дать уму как можно больше пищи »?
Cs
Os
Ag
Al
Fe
W
Li
Hg
Au
Л
.
Й
О
Т
С
Л
О
Т
Металлы - чемпионы
- Самый тугоплавкий.
- Самый распространенный в природе.
- Самый легкий.
- Самый электропроводный.
- Самый активный.
- Самый пластичный.
- Самый космический.
- Самый легкоплавкий.
- Самый тяжелый.
Слайд используется для актуализации знаний.

Что объединяет все эти изображения?
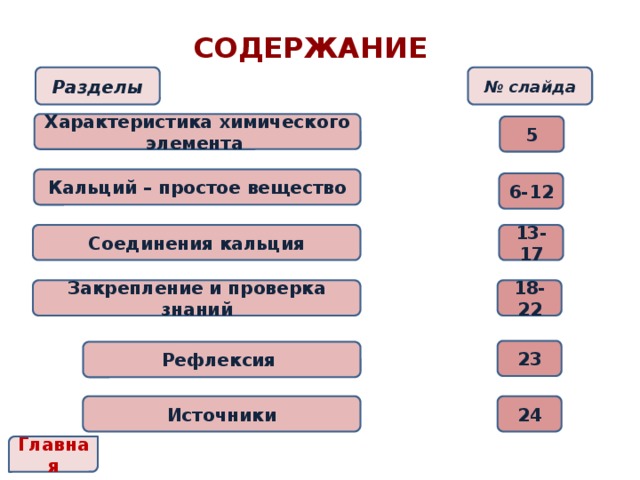
СОДЕРЖАНИЕ
№ слайда
Разделы
Характеристика химического элемента
5
Кальций – простое вещество
6-12
Соединения кальция
13-17
Закрепление и проверка знаний
18-22
23
Рефлексия
Источники
24
Главная
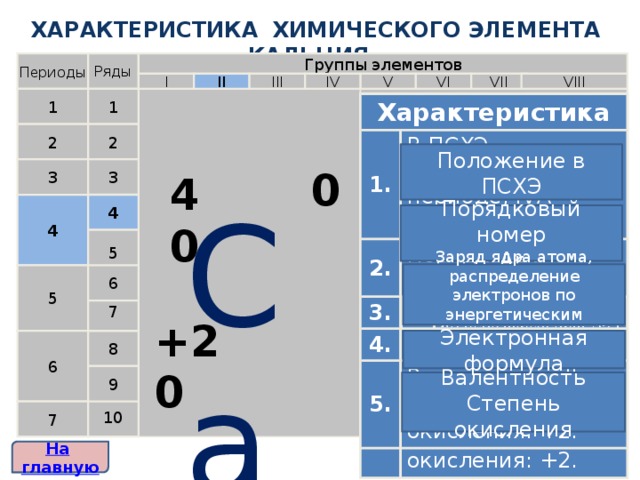
ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО ЭЛЕМЕНТА кальция
Периоды
Группы элементов
Ряды
VI
II
I
VII
III
IV
VIII
V
1
1
Характеристика
Характеристика
1.
1.
В ПСХЭ расположен в 4 периоде, IVА-группе.
В ПСХЭ расположен в 4 периоде, IVА-группе.
2.
2.
Порядковый номер 20, Аr = 40
3.
Порядковый номер 20, Аr = 40
3.
4.
Заряд ядра +20.
4.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
5.
5.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
2 , 8 , 8 , 2
Валентность: II.
Валентность: II.
Степень окисления: +2.
Степень окисления: +2.
2
2
Положение в ПСХЭ
0
3
3
40
Са
4
4
Порядковый номер
Аr
5
Заряд ядра атома, распределение электронов по энергетическим уровням
6
5
7
Для работы со слайдом необходимо кликать мышью – открываются пункты характеристики элемента.
+20
6
8
Электронная формула
9
Валентность
Степень окисления
10
7
На главную
5

нахождение в природе
Средней активности
благородные
активные
РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au
Кальций - активный металл,
в природе встречается только в виде соединений.
5 место по содержанию в земной коре.
Массовая доля в земной коре – 3,6% .
Для работы слайда необходимо кликать мышью – будет последовательно появляться текст.
В природе в виде солей: сульфатов, карбонатов, фосфатов, фторидов. Является составной частью костей и крови у человека и животных.
6

нахождение кальция в природе
Только В виде солей
СУЛЬФАТЫ, КАРБОНАТЫ, ФОСФАТЫ, ФТОРИДЫ и др.
СаSO 4* 2H 2 O
гипс
СaСO 3
СаСO 3
известняк
мел
СаСO 3
мрамор
СаСO 3*
Сa 3 (PO 4 ) 2
фосфорит
МgСO 3
доломит
Для работы слайда необходимо кликать мышью для появления текста.
Сa 5 (PO 4 ) 3 F
фторапатит
Сa 5 (PO 4 ) 3 OH
апатит
СaF 2
флюорит
7

Месторождения в казахстане
РОЗОВЫЙ РАКУШЕЧНИК
(на Мангышлаке)
ФОСФОРИТЫ
(в горах Каратау, в Актюбинской области)
ЦЕМЕНТНЫЕ ГЛИНЫ
(около Шымкента и Семея)
ГИПС
(в Жамбылской области )
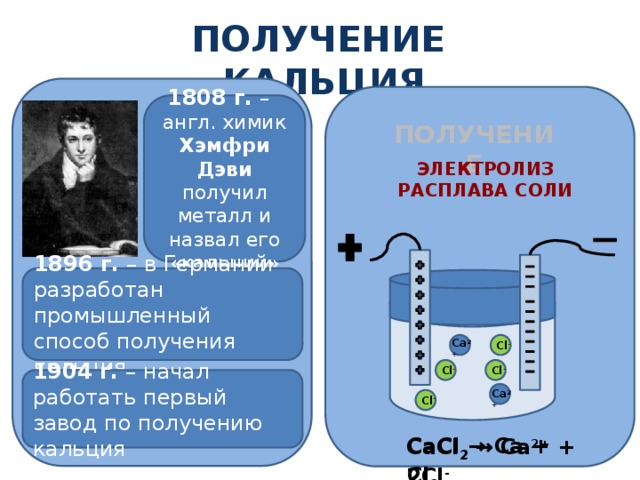
ПОЛУЧЕНИЕ КАЛЬЦИЯ
1808 г. – англ. химик Хэмфри Дэви получил металл и назвал его «кальций»
получение
Электролиз расплава соли
1896 г. – в Германии разработан промышленный способ получения кальция
Для работы слайда необходимо кликать мышью для показа процесса электролиза.
Сa 2+
Cl -
Cl -
Cl -
1904 г. – начал работать первый завод по получению кальция
Сa 2+
Cl -
СaCl 2 → Сa + Cl 2
СaCl 2 → Сa 2+ + 2Cl -
9

ФИЗИЧЕСКИЕ СВОЙСТВА КАЛЬЦИЯ
Соединения Са окрашивают пламя в кирпично-красный цвет
Т пл. = 851°С
Серебристо-белый
ρ = 1,54 г/см 3
близка к плотности щелочных металлов
Тверже щелочных металлов
Хранят кальций под слоем керосина

Химические СВОЙСТВА КАЛЬЦИЯ
Химические свойства Са
Взаимодействие со сложными веществами
Взаимодействие с простыми веществами
Ca + H 2 = CaH 2 гидрид
Ca + 2C = CaC 2 карбид
3Ca + N 2 = Ca 3 N 2 нитрид
3Ca + 2P = Ca 3 P 2 фосфид
2Ca + O 2 = 2CaO оксид
Ca + S = CaS сульфид
Ca + Cl 2 = CaCl 2 хлорид
Ca + 2H 2 O = Ca(OH) 2 + H 2
Ca + 2HCl = CaCl 2 + H 2
Ca + ВеO = CaO + Ве
2Ca + CO 2 = 2CaO + C
2Ca + SiO 2 = 2CaO + Si
t°
t°
Для работы слайда необходимо кликать мышью по красному прямоугольнику.
11

Применение КАЛЬЦИЯ
На главную

Соединения кальция
Оксид кальция
Гидроксид кальция
Соли кальция
CaО - основной оксид Ca(ОН) 2 - щелочь СаСO 3 , CaSО 4
негашеная
гашеная
известь
известь
СаСO 3 - карбонат кальция
известняк, мрамор, мел
Получение:
обжиг известняка
СаСO 3 = CaО + СО 2
СаSO 4* 2H 2 O г ипс =
СаSO 4* 0,5H 2 O + 1,5H 2 O алебастр
известковое
молоко
Для работы слайда необходимо кликать мышью для появления текста.
известковая
Гигроскопичное в-во
вода
CaО + H 2 O = Ca(OH) 2
CaО + СO 2 = СaСO 3
(для освоб-я газов от СO 2, H 2 O)
СаСO 3 + H 2 O + СO 2 = Сa(НСO 3 ) 2
гидрокарбонат кальция
13

СВОЙСТВА соединений КАЛЬЦИЯ
Химические свойства оксида и гидроксида кальция
Гидроксид кальция Са(ОН) 2 – сильное основание
СаО – основной оксид
CaО + H 2 О = Ca(ОH) 2
2) + кислотный оксид
3CaО + P 2 О 5 =Ca 3 (PО 4 ) 2
3) + кислота
CaО + Н 2 SО 4 = CaSО 4 + H 2 О
1) + кислотный оксид
Ca(ОН) 2 +СО 2 = CaСO 3 + H 2 О
2) + кислота
Ca(ОН) 2 +2HCl = CaCl 2 + 2H 2 О
3) + соль
Ca(ОН) 2 +СuCl 2 = CaCl 2 + Cu(ОН) 2
Для работы слайда необходимо кликать мышью по красному прямоугольнику.
14

Биологическая роль кальция
Недостаток кальция:
При недостатке кальция необходимо известкование, гипсование почвы
рост растений замедляется
Недостаток кальция: края листьев закручиваются, желтеют, появляются пятна
Недостаток кальция: тонкие скорлупа яиц, панцири, непрочный скелет
Необходимо кликать мышью – сначала появляется роль кальция (в синих прямоугольниках), затем признаки его недостатка (в голубых прямоугольниках).
15
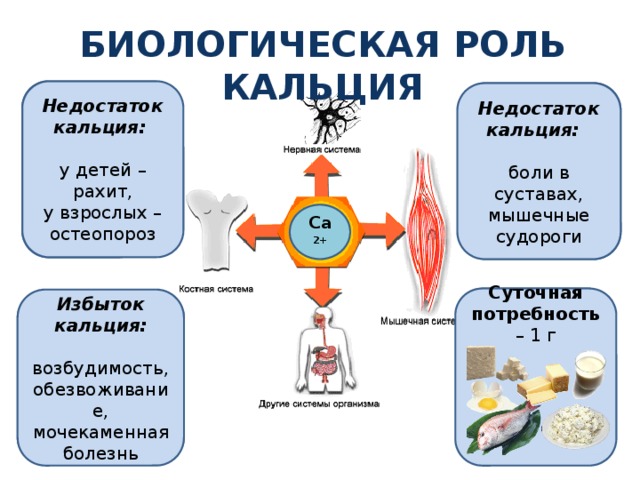
Биологическая роль кальция
Основной компонент костей скелета и зубов
Недостаток кальция:
у детей – рахит,
у взрослых – остеопороз
Для сокращения мышц, в том числе и сердечной мышцы
Недостаток кальция:
боли в суставах, мышечные судороги
Са 2+
Суточная потребность – 1 г
Участвует в регуляции деятельности более 300 ферментов
Избыток кальция:
возбудимость,
обезвоживание,
мочекаменная болезнь
Для нормального свертывания крови
Для работы слайда необходимо кликать мышью – открываются синие прямоугольники (роль кальция), затем голубые прямоугольники (признаки недостатка и избытка кальция).
15
применение Соединений кальция
Известняк, мрамор применяют в строительстве, искусстве.
Какую массу (кг) известняка с содержанием 5% примесей необходимо взять для получения 112 кг негашеной извести?
Человек в состоянии покоя выделяет в минуту 0,19 л СО 2 (н.у.).
В организме взрослого человека содержится 2% кальция, из них 99% - в костях и зубах. Рассчитайте, сколько грамм кальция находится в костях и зубах человека массой 75 кг.
Знаешь ли ты формулы?
Сколько гидроксида кальция потребуется для полного поглощения СО 2 , выдыхаемого за 8 часов сна?
210,526 кг
1,485 кг
301,3 г
Са(ОН) 2
Гипс используется в медицине, в строительных работах, для изготовления лепнины, статуэток.
ответ
ответ
Известковая вода - для обнаружения СO 2, известковое молоко – для побелки, смесь гашеной извести с песком и водой – связующее средство для кирпичной кладки и штукатурки.
Для работы слайда необходимо кликать мышью на синие прямоугольники. В 1-3 ячейках таблицы - задачи. В 4 ячейке - проверка знаний формул веществ. Слайд удобен для организации работы учащихся в группах, парах при закреплении и проверке знаний.
Доломит
Известковая вода
СаCO 3* МgCO 3
СаО
СаСO 3
Известняк
Негашеная известь
ответ
Гипс
Гашеная известь
СаSO 4 *2H 2 O
Са(ОН) 2
На главную
17

УБЕРИТЕ ЛИШНЕЕ
У атома кальция на внешнем уровне 2 электрона.
У атома кальция на внешнем уровне 2 электрона.
1
В ПСХЭ кальций расположен в 4 периоде, IVБ-группе.
2
Кальций относится к s-элементам.
Кальций относится к s-элементам.
3
Кальций относится к щелочноземельным металлам.
Кальций относится к щелочноземельным металлам.
4
Оксид кальция не взаимодействует с водой.
5
Слайд используется для закрепления знаний по теме. Необходимо кликать мышью на «лишнее», т.е. неверное высказывание.
Гидроксид кальция хорошо растворяется в воде.
6
Раствор Са(ОН) 2 окрашивает фенолфталеин в малиновый цвет.
7
Раствор Са(ОН) 2 окрашивает фенолфталеин в малиновый цвет.
Соли кальция окрашивают пламя в фиолетовый цвет.
8
17
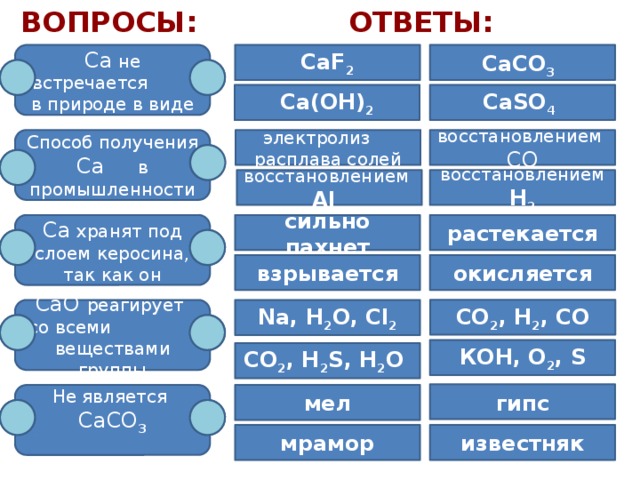
Вопросы:
Ответы:
Са не встречается в природе в виде
CaCO 3
СаF 2
Са(ОH) 2
CaSO 4
Способ получения
восстановлением СО
Са в промышленности
электролиз расплава солей
восстановлением H 2
восстановлением Al
сильно пахнет
Са хранят под слоем керосина, так как он
растекается
окисляется
взрывается
CO 2 , H 2 , CО
СaО реагирует
Na, H 2 O, Cl 2
со всеми веществами группы
При выполнении этого задания необходимо выбрать правильный ответ и щелкнуть по нему левой кнопкой мыши.
КOH, O 2 , S
CO 2 , H 2 S, H 2 O
гипс
мел
Не является
СаСО 3
мрамор
известняк
17

ВОПРОСЫ И ЗАДАНИЯ
1
Почему легкий и прочный кальций не применяется в самолето- и судостроении?
2
Кальций находился на воздухе и постепенно превратился в белый порошок. Каков состав этого порошка? Напишите уравнения возможных реакций.
3
Как следует хранить известковую воду – в открытом или закрытом сосуде? Ответ объясните с помощью уравнения реакции.
Слайд используется для закрепления и проверки знаний по теме. Слайд удобен для организации работы учащихся в группах, парах.
4
Как осуществить превращения?
СаСl 2 → Са → СаО → СаCO 3 →Са(НCO 3 ) 2 → СаCO 3 → СаO
20

Тренажер « химические свойства кальция»
+
Са + Н 2 О →
H 2
СаО
СаН 2
Са(ОН) 2
+
Ca + SiO 2 →
CaSiO 3
SiH 4
Si
CaO
+
Ca + CO 2 →
C
CO
CaO
CaCO 3
Ca + HCl →
При выполнении этого задания необходимо выбрать правильный ответ и щелкнуть по нему левой кнопкой мыши.
+
H 2
CaCl 2
CaH 2
Ca(OH) 2
Ca + N 2 →
CaN 2
Ca 3 N 2
CaN
Ca 2 H
CaH 2
CaH
Ca + H 2 →
20
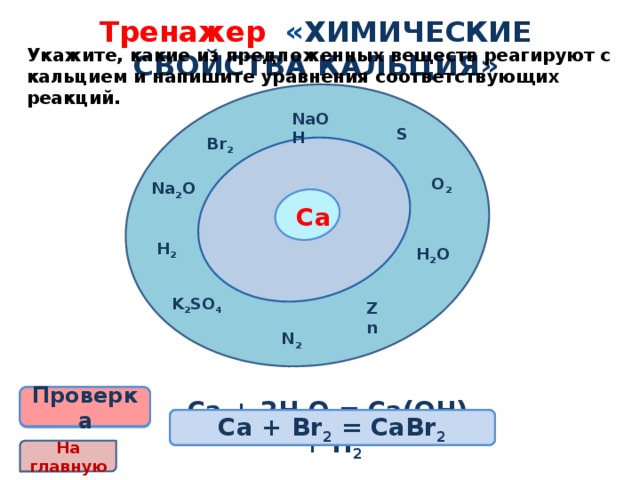
Тренажер « химические свойства кальция»
Укажите, какие из предложенных веществ реагируют с кальцием и напишите уравнения соответствующих реакций.
NaOH
S
Br 2
O 2
Na 2 O
Са
H 2
H 2 O
K 2 SO 4
Zn
N 2
Проверка
Проверка
Проверка
Проверка
Проверка
Проверка
2Са + О 2 = 2СаО
Ca + S = CaS
Са + 2Н 2 О = Са(ОН) 2 + Н 2
3Са + N 2 = Ca 3 N 2
Са + Н 2 = CaН 2
Са + Br 2 = CaBr 2
На главную
РЕФЛЕКСИЯ
Закончите предложения
Сегодня на уроке я узнал …
Мне было трудно …
Я удивился, что …
Слайд используется для проведения рефлексии.
Дома мне нужно …
На главную
20

Источники
- Нурахметов Н.Н., Сарманова К.А., Джексембина К.М. и др. Химия: Учеб. для 9 кл. общеобразоват. шк. – Алматы: Изд-во «Мектеп», 2009.
- Усманова М.Б., Сакарьянова К.Н. Химия: Учеб. для 9 кл. общеобразоват. шк. – Алматы: Атамура, 2013.
- http://ru.wikipedia.org/wiki /
- http:// fashiony.ru/page.php?id_n=38315
- http://domovouyasha.ru/kaltsiy-v-produktah-pitaniya-rol-kaltsiya-v-organizme/comment-page-1 /
- http:// nlogorod.ru/udobrenia%20kalcij.php
- http://www.uchportal.ru /