СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 08.05.2024 05:23

Колесникова Оксана Михайловна
учитель
46 лет
Местоположение
Россия, Иваново
Специализация
Кислород. Получение кислорода и его физические свойства
Категория:
Химия
07.02.2021 20:19
© 2021, Колесникова Оксана Михайловна 308 0









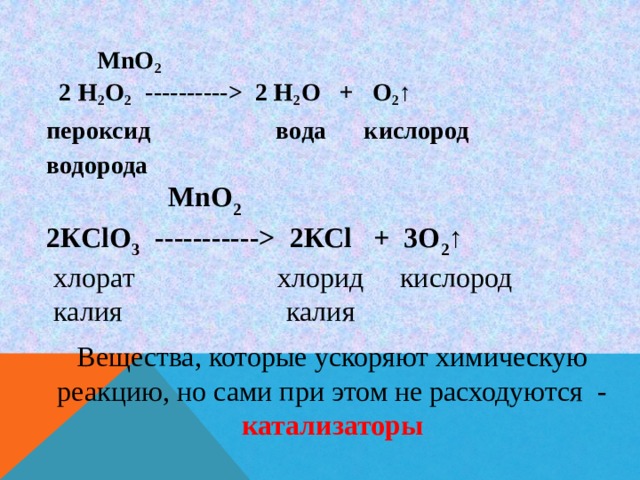
 2 Н 2 О + О 2 ↑ пероксид вода кислород водорода MnO 2 2КСlО 3 ----------- 2КСl + 3O 2 ↑ хлорат хлорид кислород калия калия Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы " width="640"
2 Н 2 О + О 2 ↑ пероксид вода кислород водорода MnO 2 2КСlО 3 ----------- 2КСl + 3O 2 ↑ хлорат хлорид кислород калия калия Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются - катализаторы " width="640"