Просмотр содержимого документа
«Ковалентная связь»

ГБПОУ «Починковский сельскохозяйственный техникум»
Химическая связь
Ковалентная связь

Свойства веществ зависят
от строения
Атома
Молекулы
Кристалла

- Молекулы веществ состоят из двух, трех, четырех и большего количества атомов
- И только молекулы инертных газов одноатомны
- Составьте схема атомов кальция, азота, неона, аргона, гелия

- Стремление к стабильности

Химическая связь – это
силы взаимодействия,
которые соединяют
отдельные атомы в
молекулы, ионы,
кристаллы .

Валентность –
это способность атома
образовывать определенное число химических связей
с другими атомами .
Величина валентности элемента
определяется числом химических связей,
которые атом элемента образует с
другими атомами.
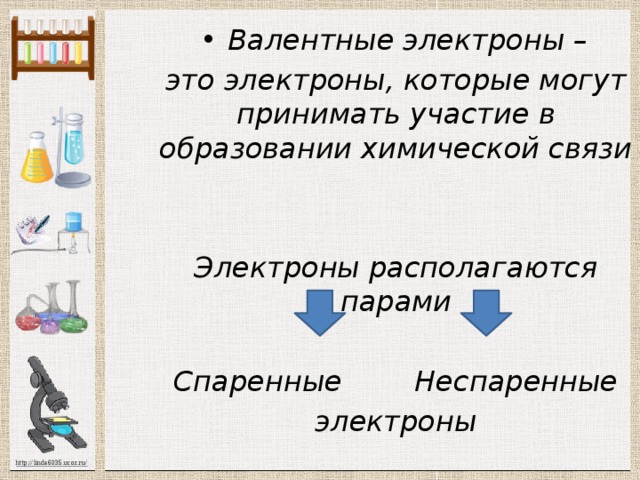
это электроны, которые могут принимать участие в образовании химической связи
Электроны располагаются парами
Спаренные Неспаренные
электроны

группа
Число
валентных
4
IV
V
Число
электронов
5
Валентные
неспаренных
электроны
VI
6
электронов
показаны
VII
7
4
точками
3
2
1

- Число неспаренных электронов =
= 8 - № группы
S 2
N 3
Cl
Si
P
Se
Br

Как завершить внешний энергетический уровень?
- Надо добавить электроны на внешний уровень.
- Где взять такие электроны?

. .
А + В
А : В
Общая
электронная
пара
Неспаренные
электроны

Ковалентная связь –
это химическая связь, возникающая в результате образования
общих электронных пар
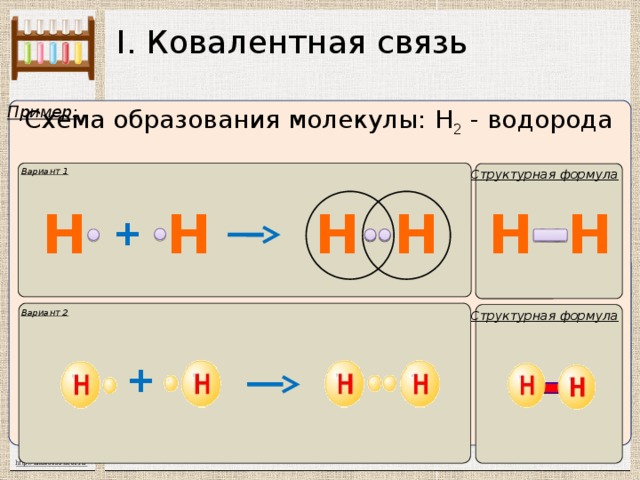
I. Ковалентная связь
Пример:
Схема образования молекулы: Н 2 - водорода
Вариант 1
Структурная формула
Н
Н
Н
Н
Н
Н
Н
Н
+
Вариант 2
Структурная формула
+
13
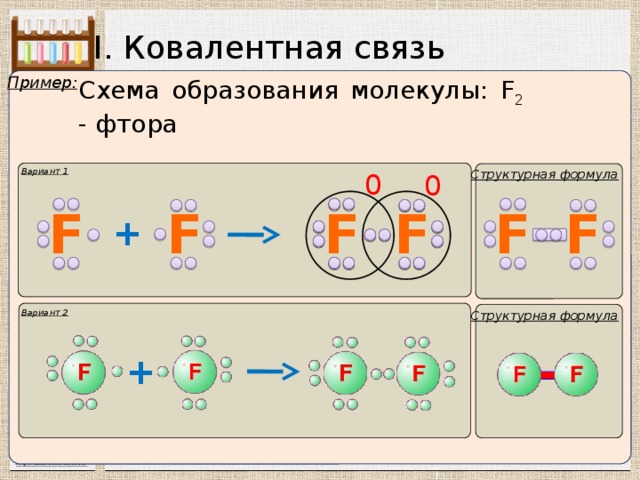
I. Ковалентная связь
Пример:
Схема образования молекулы: F 2 - фтора
Вариант 1
Структурная формула
0
0
F
F
F
F
F
F
F
F
+
Вариант 2
Структурная формула
+
14

Д.З. Параграф 14 ,

Интернет-ресурсы:
Микроскоп http://img-fotki.yandex.ru/get/9299/134091466.f5/0_d4d6e_ccd0a668_S
Колбы http://img-fotki.yandex.ru/get/6613/134091466.a/0_8eae3_6ea58e84_S
Пробирки http://img-fotki.yandex.ru/get/9300/134091466.c5/0_c98b9_19d24419_S
Горелка http://img-fotki.yandex.ru/get/4904/134091466.f5/0_d4d6d_4740c1eb_S
Колбы http://img-fotki.yandex.ru/get/9558/134091466.9a/0_c0378_bebb161_S
Блокнот с ручкой http://img-fotki.yandex.ru/get/19/108950446.6d/0_b4102_1793a431_S

































