Пояснительная записка
1. Назначение КИМа для промежуточной аттестационной работы
Контрольно-измерительный материал предназначен для проведения промежуточной аттестации по химии в 9 классе в форме годовой контрольной работы с фиксацией результатов по пятибалльной системе.
Цель работы: Выявить сформированность базовых умений по химии на второй ступени общего образования.
2. Документы, определяющие содержание ВПР
Содержание контрольно-измерительного материала по химии определяется на основе Федерального компонента государственного образовательного стандарта среднего (полного) общего образования по химии, базовый уровень (приказ Минобразования России от 05.03.2004 № 1089 «Об утверждении Федерального компонента государственных стандартов начального общего, основного общего и среднего (полного) общего образования»).
3. Подходы к отбору содержания и разработке структуры КИМа
На основании ФК ГОС по химии базового уровня разработан кодификатор, определяющий перечень элементов содержания и перечень способов деятельности, выносимых на итоговую проверку.
Разработка КИМа по химии осуществляется с учетом следующих общих положений:
КИМ ориентирован на проверку усвоения системы знаний и умений, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для средней школы. В Федеральном компоненте Государственного стандарта среднего общего образования эта система знаний и умений представлена в виде требований к уровню подготовки выпускников по химии (базовый уровень);
проверка сформированности усвоения основных элементов содержания курса химии осуществляется на двух уровнях сложности: базовом и повышенном;
учебный материал, проверяемый заданиями КИМа, отбирается с учетом его общекультурной значимости для общеобразовательной подготовки выпускников средней школы
4. Структура и содержание КИМа
Каждый вариант КИМа содержит 14 заданий различных типов и уровней сложности.
| Форма задания | Номера заданий |
| С выбором 1 ответа | 1,2,3 |
| На установление соответствия | 5,6,7,8 |
| С выбором 2 ответов | 9,10,11 |
| На восстановление последовательности | 4 |
| С кратким ответом | 12 |
| С развернутым ответом | 13,14 |
Данная работа соответствуют обязательному минимуму содержания по химии и требованиям к уровню подготовки выпускников 9-го класса основной общеобразовательной школы. Каждый вариант содержит четырнадцать заданий из них двенадцать базового уровня: три задания с выбором 1 ответа по разным темам курса, три задания с выбором 2 ответов, четыре на установление соответствия, один на восстановление последовательности, один с кратким ответом и два задания с полным решением – повышенного уровня.
Задания с выбором ответа проверяют на базовом уровне усвоение большого количества элементов содержания, предусмотренных Обязательным минимумом содержания основного общего образования.
Задания с кратким ответом направлены как на проверку усвоения того же материала, что и задания с выбором ответа, так и наиболее трудно усваиваемых элементов содержания курса химии 8 класса.
Задания с развёрнутым ответом наиболее сложные. Они проверяют усвоение учащимися способов получения и химических свойств различных классов веществ, взаимосвязь между классами неорганических соединений, умений проводить расчёты по химическим уравнениям и формулам.
Задания проверочной работы ориентированы на проверку овладения учащимися определёнными видами умений.
План КИМа
| Вопрос | Проверяемый элемент | Коды проверяемых элементов содержания (см. кодификатор ОГЭ) |
| А1 | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева. | 1.1 |
| А2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева | 1.2 |
| А3 | Строение молекул. Химическая связь: ковалентная (полярная и неполярная), ионная | 1.3 |
| А4 | Степень окисления химических элементов | 1.4 |
| А5 | Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений | 1.6 |
| А6 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии | 2.1 2.2 |
| А7 | Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей. | 2.3 2.4
|
| А8 | Реакции ионного обмена и условия их осуществления | 2.5 |
| А9 | Химические свойства простых веществ. Химические свойства сложных веществ. | 3.1 3.2 |
| А10 | Первоначальные сведения об органических веществах: предельных и непредельных углеводородах (метане, этане, этилене, ацетилене) и кислородсодержащих веществах: спиртах (метаноле, этаноле, глицерине), карбоновых кислотах (уксусной и стеариновой). Биологически важные вещества: белки, жиры, углеводы | 3.4 |
| А11 | Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак) | 4.2 4.3 |
| А12 | Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции | 4.5.2 4.5.3 |
| В1 | Взаимосвязь различных классов неорганических веществ. | 3.3 |
| В2 | Расчетная задача по уравнению реакции | 4.5.3 |
| Спецификация работы |
|
| № задания | Проверяемые умения | Уровень | Код умения |
| Знать |
|
|
| А2 | смысл основных законов и теорий химии: атомно- молекулярная теория; законы сохранения массы веществ, постоянства состава; Периодический закон Д.И. Менделеева; закономерности изменения строения атомов, свойств элементов в пределах малых периодов и главных подгрупп, а также свойства образуемых ими высших оксидов; | Б | 1.3 2.2.2 |
| А7 | важнейшие химические понятия: электролиты и неэлектролиты, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, основные типы реакций в неорганической химии; | Б | 1.2 |
| А10 | первоначальные сведения о строении органических веществ | Б | 1.4 |
| Называть |
|
|
| А5 | Называть химические соединения по формулам | Б | 2.1.2 |
| А6 | Называть признаки и условия осуществления химических реакций | Б |
|
| Составлять |
|
|
| А1 | Составлять схемы строения атомов первых 20 элементов Периодической системы Д.И. Менделеева Составлять формулы веществ по названию | Б | 2.5.1 |
| А6, В1 | Составлять уравнения химических реакций | Б П | 2.5.3 |
| Характеризовать |
|
|
| А9 | Характеризовать взаимосвязь между составом, строением и свойствами неорганических веществ; характерные химические свойства основных классов соединений | Б | 2.3.2 2.3.3 |
| А10 | Характеризовать взаимосвязь между составом, строением и свойствами отдельных представителей органических веществ | Б | 2.3.4 |
| Объяснять |
|
|
| А1 | Объяснять физический смысл порядкового номера химического элемента, номеров группы (для элементов главных подгрупп) и периода в Периодической системе, к которым принадлежит элемент; | Б |
|
| А7 | Объяснять сущность процесса электролитической диссоциации и реакций ионного обмена | Б | 2.2.3 |
| Определять |
|
|
| А3 | Определять вид химической связи | Б | 2.4.3 |
| А4 | Определять валентность и степень окисления элемента в соединении | Б | 2.4.2 |
| А5 | Определять принадлежность веществ к определенному классу неорганических соединений | Б | 2.4.4 |
| А6 | Определять типы химических реакций | Б | 2.4.5 |
| А8 | Определять возможность протекания реакций ионного обмена | Б | 2.4.6 |
| А11 | Определять газообразные вещества: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей по изменению окраски индикатора; кислоты, щелочи и соли по наличию в их растворах хлорид-,сульфат-, карбонат-ионов и иона аммония | Б | 2.7.3 2.7.4 2.7.5 |
| Вычислять |
|
|
| А12 | Вычислять массовую долю вещества в растворе | Б | 2.8.2 2.8.3 |
| В2 | Вычислять количество вещества, объем или массу по количеству вещества, объему, или массе реагентов, или продуктов реакции. | П | 2.8.2 2.8.3 |
Инструкция для учителя
Условия:
Количество вариантов заданий
Для проведения промежуточной аттестационной работы предусмотрено 2 варианта.
Время выполнения работы
На выполнение всей работы отводится 45 минут.
Дополнительные материалы и оборудование
В процессе выполнения работы учащийся может использовать следующие дополнительные материалы:
Периодическая система химических элементов Д.И. Менделеева;
таблица растворимости солей, кислот и оснований в воде;
электрохимический ряд напряжений металлов;
непрограммируемый калькулятор.
Последовательность выполнения заданий
При выполнении работы сначала выполняются задания базового уровня сложности (1-12), затем повышенного.
Правила оформления работы
Ответы на задания итоговой аттестационной работы записываются в тексте работы в отведенных для этого местах. В инструкции к варианту описываются правила записи ответов к заданиям.
Перечень литературы, учебников рекомендованный учащимся для подготовки к аттестации по данному учебному предмету, курсу
К выполнению работы можно готовиться по учебникам: - Химия 9 класс Г.Е. Рудзитис, Ф.Г. Фельдман (2012 год)
Критерии оценки
Система оценивания отдельных заданий и работы в целом
Задания 1,2,3 оцениваются по 1 баллу. Задания 4 - 12 – в 2 балла. Задания 13,14 – в 3 балла. Всего – 27 баллов.
Оценивание заданий повышенного уровня сложности осуществляется на основе поэлементного анализа ответов учащихся. Максимальная оценка за верно выполненное задание составляет 3 балла. Задания с развернутым ответом могут быть выполнены учащимися разными способами. Поэтому приведенные в критериях оценивания образцы решений следует рассматривать лишь как один из возможных вариантов ответа.
Результаты обучения оцениваются по пятибалльной системе.
Оценивание:
14 – 19 - первичных баллов – оценка «3»
20-24 – оценка «4»
25-27 – оценка «5»
.
Эталоны ответов
| № вопроса | 1 вариант | 2 вариант |
| 1 | 4 | 4 |
| 2 | 1 | 4 |
| 3 | 3 | 1 |
| 4 | 1,4,2,3 | 2,4,1,3 |
| 5 | БАГВ | БАГВ |
| 6 | 1,3,2 | 431 |
| 7 | ГВДА | ГВДА |
| 8 | 3,1,4 | 2,3,4 |
| 9 | 3,4 | 2,5 |
| 10 | 4,5 | 2,5 |
| 11 | 2,5 | 1,5 |
| 12 | 20% | 6% |
| В1 |
|
|
| В2 | 9 г | 7,5 г |
Промежуточная аттестация по курсу 9 класса (УМК Рудзитиса, Фельдмана)
Вариант 1
В заданиях А1-А3 выберите один верный ответ из четырех предложенных.
А1. На приведённом рисункеизображена модель атома

1) хлора 2) азота 3) магния 4) фтора
Ответ
А2. В каком ряду химических элементов усиливаются неметаллические свойства
соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
Ответ:
А3. В молекуле фтора химическая связь
1) ионная2) ковалентная полярная
3) ковалентная неполярная4) металлическая
Ответ:
А4. Расположите формулы веществ по увеличению степени окисления хлора в них
А5. Установите соответствие между формулой соединения и классом, к которому относится это соединение
SO2 | А) кислота |
H2CO3 | Б)оксид |
CaSiO3 | В)основание |
Mg(OH)2 | Г) соль |
Ответ:
А6. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРИЗНАК РЕАКЦИИ
А) BaCl2 и AgNO3 1) выпадение белого осадка
Б) CuCl2 и NaOH 2) выпадение бурого осадка
В) FeCl3 и Ba(OH)23) выпадение голубого осадка
4) выделение газа
Ответ:
А7. Установите соответствие между формулой соединения ионами, на которые распадется данное вещество при растворении
| ФОРМУЛА ЭЛЕКТРОЛИТА | ИОНЫ, ОБРАЗОВАВШИЕСЯ ПРИ ДИССОЦИАЦИИ |
Al2(SO4)3 | А) Mg 2+и OH- |
NH4NO3 | Б) NH4+и NO32- |
CuCl2 | В)NH4+и NO3- |
Mg(OH)2 | Г) Al 3+и SO42- |
|
| Д) Cu2+иCl- |
|
| Е) Cu+ и Cl- |
Ответ:
А8.Установите соответствие между формулами двух веществ и реактивом,
с помощью которого можно различить эти вещества.
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАКТИВ |
| А) HCl и HNO3 Б) Bа(NO3)2 и Na2SO4 В) KCl и NH4Cl | 1) карбонат калия 2) соляная кислота 3) медь 4) гидроксид натрия |
В заданиях А9-А11 выберите 2 пары ответов
А9. Газ выделяется при взаимодействии
1) MgCl2 и Ba(NO3)2
2) Na2CO3 и CaCl2
3) NH4Cl и NaOH
4) Na2CO3 и НCl
5) CuSO4 и KOH
Ответ:
А10. Хлорид бария может реагировать с:
NaOH 2) NaCl 3) HCl 4)K2SO4 4) AgNO3
Ответ:
А11. Для этана верны следующие утверждения:
молекула содержит шесть атомов углерода
является предельным углеводородом
характерны реакции присоединения
атомы углерода в молекуле соединены тройной связью
вступает в реакцию с хлором
Ответ: А12. К 400 г 10%-ного раствора соли добавили 50 г этой же соли. Чему равна массовая доля соли (в %) в полученном растворе? Ответ запишите с точностью до целых.
Ответ: ___________.
В1. Дана схема превращений:
Al → AlCl3 → X t → Al2O3
Напишите уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение.
Ответ:
В2. Рассчитайте массу хлорида алюминия, образующегося при взаимодействии избытка алюминия с 2,24 л (н. у.) хлора. Ответ укажите в граммах с точностью до целых.
Дано: Решение:
Найти:
Промежуточная аттестация по курсу 9 класса (УМК Рудзитиса, Фельдмана)
Вариант 2
В заданиях А1-А3 выберите один верный ответ из четырех предложенных.
А1. На приведённом рисунке изображена модель атома
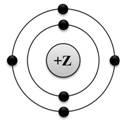
1) хлора 2) азота 3) магния 4) углерода
Ответ
А2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
фтор → азот → бор
магний → натрий → калий
хлор → сера → кремний
алюминий → кремний → фосфор
Ответ:
А3. В каком веществе ковалентная полярная связь?
HCl 2)KCl 3) K2O 4)O2
Ответ:
А4. Расположите формулы веществ по увеличению степени окисления хлора в них
| 1)KClO3 | 3)HClO4 |
| 2)AlCl3 | 4)Ca(ClO2)2 |
Ответ:
А5. Установите соответствие между формулой соединения и классом, к которому относится это соединение
СO2 | А) кислота |
H2SO3 | Б)оксид |
CaSiO3 | В)основание |
Ca(OH)2 | Г) соль |
Ответ:
А6. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРИЗНАК РЕАКЦИИ
А) KOH и FeCl2 1) выпадение белого осадка
Б) KOH и CuCl2 2) выпадение чёрного осадка
В) Ba(NO3)2 и FeSO43) выпадение голубого осадка
4) выпадение серо-зелёного осадка
Ответ:
А7. Установите соответствие между формулой соединения и ионами, на которые распадется данное вещество при растворении
| ФОРМУЛА ЭЛЕКТРОЛИТА | ИОНЫ, ОБРАЗОВАВШИЕСЯ ПРИ ДИССОЦИАЦИИ |
| 1) Al2(SO4)3 | А) Mg 2+и 2OH- |
NH4NO3 | Б) NH4+и NO32- |
CuCl2 | В)NH4+и NO3- |
Mg(OH)2 | Г) Al 3+и SO42- |
|
| Д) Cu2+и Cl- |
|
| Е) Cu+ и Cl- |
Ответ:
А8.Установите соответствие между формулами двух веществ и реактивом,
с помощью которого можно различить эти вещества.
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАКТИВ |
| А) HCl(р-р) и KOH Б)FeSO4 и CuCl2 В) Ag и Mg | 1) O2 2) лакмус 3) NaOH(р-р) 4) H2SO4 (р-р) |
В заданиях А9-А11 выберите 2 пары ответов
А9. Осадок выделяется при взаимодействии
1) MgCl2 и Ba(NO3)2
2) Na2CO3и CaCl2
3) NH4Cl и NaOH
4) Na2CO3и НCl
5) CuSO4и KOH
Ответ: А10. Хлорид кальция может реагировать с:
NaOH 2) Na2CО3 3) HCl 4) K2SO45)AgNO3
Ответ:
А11. Для этана верны следующие утверждения:
относительная молекулярная масса равна 28
является жидкостью (н.у.)
атомы углерода в молекуле соединены одинарной связью
вступает в реакцию с водородом
сгорает с образованием углекислого газа и воды
Ответ: А12. К 240 г раствора с массовой долей соли 10% добавили 160 мл воды. Определите массовую долю соли в полученном растворе. (Запишите число с точностью до целых.)
Ответ: ___________.
В1. Дана схема превращений:
P2O5 → X → K3PO4 → Ca3(PO4)2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для последнего превращения составьте сокращённое ионное уравнение.
Ответ:
В2. Литий массой 3,5 г сожгли в кислороде. Рассчитайте массу оксида лития, образовавшегося при этом. Ответ укажите в граммах с точностью до десятых.
Дано: Решение:
Найти:


















