
Prezentacii.com
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И.Менделеева

Характеристика металлов главной подгруппы I группы
Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять» , это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
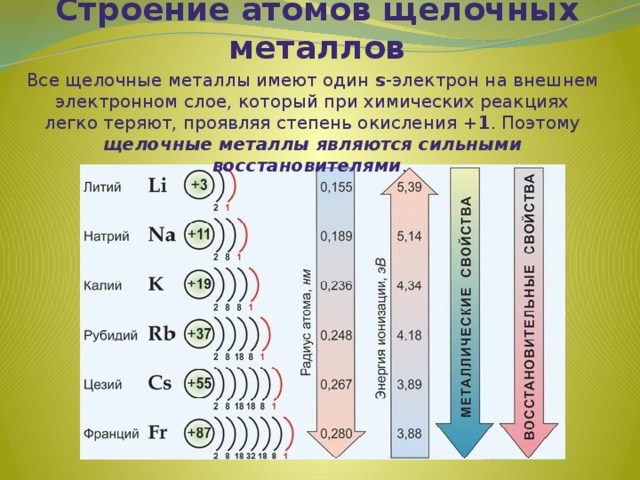
Строение атомов щелочных металлов
Все щелочные металлы имеют один s -электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1 . Поэтому щелочные металлы являются сильными восстановителями .

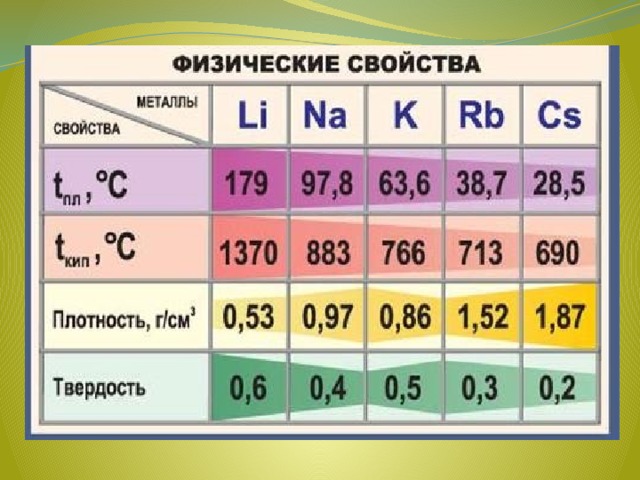
Физические свойства
цезий
литий
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней. Поэтому хранят эти металлы под слоем керосина или парафина.
калий
рубидий
натрий

Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов , чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов :
катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.

Химические свойства
Реакции с неметаллами
(образуются бинарные соединения):
4Li + O 2 2Li 2 O(оксид лития)
2Na + O 2 Na 2 O 2 (пероксид натрия)
K + O 2 KO 2 (надпероксид калия )
2Li + Cl 2 = 2LiCl(галогениды)
2Na + S = Na 2 S(сульфиды)
2Na + H 2 = 2NaH(гидриды)
6Li + N 2 = 2Li 3 N(нитриды)
2Li + 2C = 2Li 2 C 2 (карбиды)

Активно взаимодействуют с водой:
2Na + 2H 2 O 2NaOH + H 2
2Li + 2H 2 O 2LiOH + H 2
Реакция с кислотами:
2Na + 2HCl 2NaCl + H 2

Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
Li+ - карминово-красный
Na+ - желтый
K+, Rb+ и Cs+ - фиолетовый
Так выглядит проба на окрашивание пламени солями натрий
Карминово-красное окрашивание пламени солями лития
Окрашивание пламени горелки ионами калия
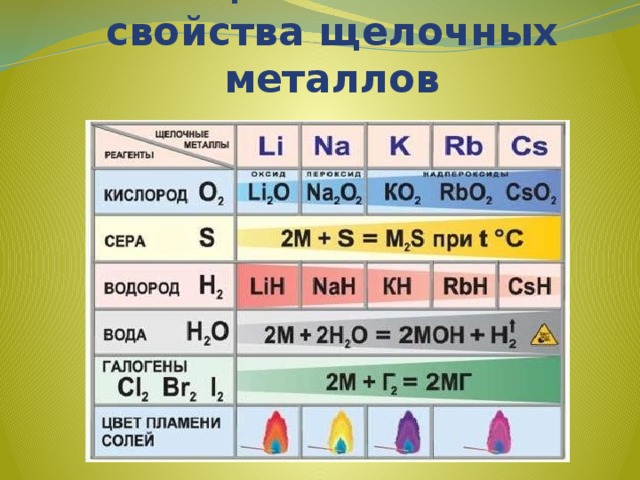
Обобщим химические свойства щелочных металлов
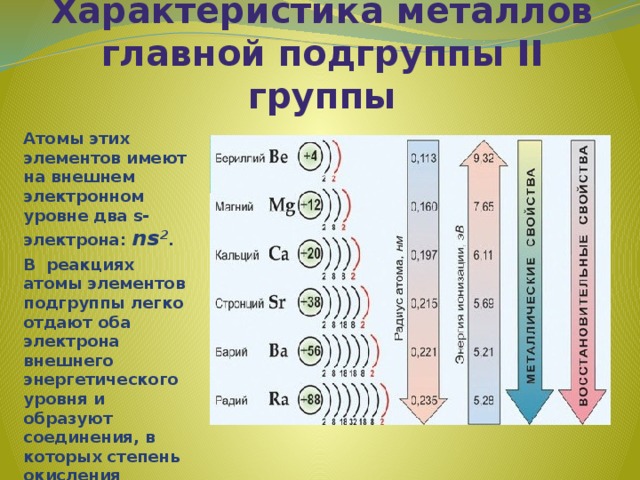
Характеристика металлов главной подгруппы II группы
Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: ns 2 .
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2 .

Физические свойства
Бериллий, магний, кальций, барий и радий - металлы серебристо-белого цвета. Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом.

Получение щелочноземельных металлов
Электролизом расплавов их хлоридов или термическим восстановлением их соединений:
BeF 2 + Mg = Be + MgF 2
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al 2 O 3
3BaO + 2Al = 3Ba + Al 2 O 3

Химические свойства
Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки.
кальций
магний
бериллий

Взаимодействие с простыми веществами
Все легко взаимодействуют с кислородом и серой, образуя оксиды и сульфаты:
2Be + O 2 = 2BeO
Ca + S = CaS
Бериллий и магний реагируют с кислородом и серой при нагревании, остальные металлы - при обычных условиях.
Все металлы этой группы легко реагируют с галогенами:
Mg + Cl 2 = MgCl 2
При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами:
Ca + H 2 = CaH 2 (гидрид кальция)
3Mg + N 2 = Mg 3 N 2 (нитрид магния)
Ca + 2C = CaC 2 (карбид кальция)

Взаимодействие с кислотами
Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода:
Be + 2HCl = BeCl 2 + H 2
Разбавленную азотную кислоту металлы восстанавливают главным образом до аммиака или нитрата аммония:
2Ca + 10HNO 3 (разб.) = 4Ca(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
В концентрированных азотной и серной кислотах (без нагревания) бериллий пассивирует, остальные металлы реагируют с этими кислотами.
![Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H 2 O = Na 2 [Be(OH) 4 ] + H 2 Остальные металлы II группы с щелочами не реагируют.](https://fsd.multiurok.ru/html/2018/10/11/s_5bbf3cf4bb29f/img16.jpg)
Взаимодействие со щелочами
Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2H 2 O = Na 2 [Be(OH) 4 ] + H 2
Остальные металлы II группы с щелочами не реагируют.
![Алюминий 13 Al [Ne] 3s 2 3p 1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.](https://fsd.multiurok.ru/html/2018/10/11/s_5bbf3cf4bb29f/img17.jpg)
Алюминий
13 Al [Ne] 3s 2 3p 1
Алюминий находится в главной п/группе III группы периодической системы.
На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.

Физические свойства
Металл серебристо-белого цвета, легкий, плотность 2,7 г/см³, температура плавления у технического 658 °C, у алюминия высокой чистоты 660 °C, температура кипения 2500 °C, временное сопротивление литого 10-12 кг/мм², деформируемого 18-25 кг/мм2,сплавов 38-42 кг/мм².
Твердость по Бринеллю 24-32 кгс/мм², высокая пластичность: у технического 35 %, у чистого 50 %, прокатывается в тонкий лист и даже фольгу.

Химические свойства
С простыми веществами:
1) С кислородом:
4Al 0 + 3O 2 → 2Al +3 2 O 3
2) С галогенами:
2Al 0 + 3Br 2 0 → 2Al +3 Br 3
3) С другими неметаллами (азотом, серой, углеродом) реагирует при нагревании:
2Al 0 + 3S t° → Al 2 +3 S 3 (сульфид алюминия)
2Al 0 + N 2 t° → 2Al +3 N(нитрид алюминия)
4Al 0 + 3С → Al 4 +3 С 3 (карбид алюминия)
Сульфид и карбид алюминия полностью гидролизуются:
Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ¯ + 3H 2 S
Al 4 C 3 + 12H 2 O → 4Al(OH) 3 ¯+ 3CH 4
![Со сложными веществами: 4) С водой (после удаления защитной оксидной пленки): 2Al 0 + 6H 2 O ® 2Al +3 (OH) 3 + 3H 2 5) Со щелочами: 2Al 0 + 2NaOH + 6H 2 O ® 2Na[Al +3 (OH) 4 ] (тетрагидроксоалюминат натрия) + 3H 2 6) Легко растворяется в соляной и разбавленной серной киcлотах: 2Al + 6HCl ® 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 (разб) ® Al 2 (SO 4 ) 3 + 3H 2 При нагревании растворяется в кислотах - окислителях: 2Al + 6H 2 SO 4 (конц) ® Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O Al + 6HNO 3 (конц) ® Al(NO 3 ) 3 + 3NO 2 + 3H 2 O 7) Восстанавливает металлы из их оксидов (алюминотермия): 8Al 0 + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe 2Al + Cr 2 O 3 ® Al 2 O 3 + 2Cr](https://fsd.multiurok.ru/html/2018/10/11/s_5bbf3cf4bb29f/img20.jpg)
Со сложными веществами:
4) С водой (после удаления защитной оксидной пленки):
2Al 0 + 6H 2 O ® 2Al +3 (OH) 3 + 3H 2
5) Со щелочами:
2Al 0 + 2NaOH + 6H 2 O ® 2Na[Al +3 (OH) 4 ]
(тетрагидроксоалюминат натрия) + 3H 2
6) Легко растворяется в соляной и разбавленной серной киcлотах:
2Al + 6HCl ® 2AlCl 3 + 3H 2
2Al + 3H 2 SO 4 (разб) ® Al 2 (SO 4 ) 3 + 3H 2
При нагревании растворяется в кислотах - окислителях:
2Al + 6H 2 SO 4 (конц) ® Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Al + 6HNO 3 (конц) ® Al(NO 3 ) 3 + 3NO 2 + 3H 2 O
7) Восстанавливает металлы из их оксидов (алюминотермия):
8Al 0 + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe
2Al + Cr 2 O 3 ® Al 2 O 3 + 2Cr

Получение алюминия

Применение алюминия
— в электротехнике — для производства легких сплавов (дюралюмин, силумин) в самолето- и автомобилестроении — для алитирования чугунных и стальных изделий с целью повышения их коррозионной стойкости — для термической сварки — для получения редких металлов в свободном виде — в строительной промышленности — для изготовления контейнеров, фольги и т.п.

Задания для закрепления знаний:
Осуществить цепочку превращений:
Аl → АlСl 3 → Аl(ОН) 3 → Аl 2 О 3 → Nа Аl О 2 → Аl 2 (SО) 3 → Аl(ОН) 3 → АlСl 3 → NаАlО 2

Найди соответствие
1 . Активные металлы
2. Металлы средней активности
3. Благородные металлы
А) Au, Ag, Pt
Б) Zn, Fe, Cu
В) Na, K, Ca

Вставьте пропущенное слово:
Наиболее выраженные металлические свойства проявляет:
? алюминий
? натрий
? магний
? бериллий
? железо
Активнее других реагирует с кислородом....
? алюминий
? серебро
? цинк
? барий
При комнатной температуре вытесняет водород из воды...
? медь
? железо
? литий
? цинк

Калий взаимодействует с водой с образованием.... и ....
? соли
? водорода
? щелочи
? оксида калия
В химических реакциях атом алюминия - ...
? окислитель
? восстановитель
? окислитель и восстановитель
? не отдает и не принимает электроны
Какой металл не используют для вытеснения менее активных металлов из растворов их солей?
? железо
? магний
? натрий
? цинк

Решите задачи:
Задача № 1 При обработке 8г смеси магния и оксида магния соляной кислотой выделилось 5,6 л водорода(н.у.). Какова массовая доля (в %) магния в исходной смеси?
Задача № 2 Калий массой 3,9 г растворили в воде массой 206,2 г. Определите массовую долю полученного раствора.

Домашнее задание: напишите уравнения согласно схеме, составьте рассказ о свойствах алюминия
О 2
Al
С L 2
простые
вещества
N 2
+
S
H 2 O
HCl
сложные
вещества
NaOH+H 2 O
Fe 2 O 3
Схема ответа:
Строение атома
металла
Открытие
металла и
получение
Нахождение
в природе
Применение
Физические
свойства
Химические
свойства
























![Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода: Be + 2NaOH + 2H 2 O = Na 2 [Be(OH) 4 ] + H 2 Остальные металлы II группы с щелочами не реагируют.](https://fsd.multiurok.ru/html/2018/10/11/s_5bbf3cf4bb29f/img16.jpg)
![Алюминий 13 Al [Ne] 3s 2 3p 1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом уровне имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.](https://fsd.multiurok.ru/html/2018/10/11/s_5bbf3cf4bb29f/img17.jpg)


![Со сложными веществами: 4) С водой (после удаления защитной оксидной пленки): 2Al 0 + 6H 2 O ® 2Al +3 (OH) 3 + 3H 2 5) Со щелочами: 2Al 0 + 2NaOH + 6H 2 O ® 2Na[Al +3 (OH) 4 ] (тетрагидроксоалюминат натрия) + 3H 2 6) Легко растворяется в соляной и разбавленной серной киcлотах: 2Al + 6HCl ® 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 (разб) ® Al 2 (SO 4 ) 3 + 3H 2 При нагревании растворяется в кислотах - окислителях: 2Al + 6H 2 SO 4 (конц) ® Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O Al + 6HNO 3 (конц) ® Al(NO 3 ) 3 + 3NO 2 + 3H 2 O 7) Восстанавливает металлы из их оксидов (алюминотермия): 8Al 0 + 3Fe 3 O 4 ® 4Al 2 O 3 + 9Fe 2Al + Cr 2 O 3 ® Al 2 O 3 + 2Cr](https://fsd.multiurok.ru/html/2018/10/11/s_5bbf3cf4bb29f/img20.jpg)





























