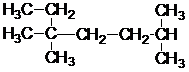МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по выполнению самостоятельной работы
по дисциплине ОУДп.12 ХИМИЯ
специальность 15.02.01 Монтаж и техническая эксплуатация промышленного оборудования (по отраслям)
Содержание
Стр.
Пояснительная записка 3
1. Карта самостоятельной работы обучающегося 4
2. Порядок выполнения самостоятельной работы
обучающимся 7
2.1 Инструкции по выполнению различных видов самостоятельной
работы, предусмотренные рабочей программой УД 8
2.2 Методические указания по выполнению самостоятельной работы 10
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методические указания по выполнению самостоятельной работы (далее методические указания) составлены в соответствии с рабочей программой дисциплины ОУДп.12 Химия.
Целью методических указаний является оказание помощи обучающимся в выполнении самостоятельной работы по учебной дисциплине ОУДп.12 Химия.
Задачами методических указаний по организации самостоятельной работы являются:
- активизация самостоятельной работы обучающихся;
- определение содержания самостоятельной работы обучающихся;
- установление требований к различным формам самостоятельной работы;
- определение порядка выполнения самостоятельной работы обучающимся;
- формулирование методических рекомендаций по выполнению самостоятельной работы.
Методические указания состоят из карты самостоятельной работы обучающегося, инструкции по выполнению различных видов самостоятельной работы, методических указаний по выполнению, списка рекомендованной литературы.
Для выполнения самостоятельной работы рекомендуется пользоваться конспектами занятий, учебной литературой, которая предложена в списке рекомендуемой литературы, Интернет-ресурсами или другими источниками по усмотрению обучающегося
При освоении учебной дисциплины предусматриваются различные виды самостоятельной работы обучающегося:
1) для освоения теоретических знаний:
- чтение текста (учебника, первоисточника, дополнительной литературы и т.д.);
- анализ, структурирование и логически последовательное изложение текста в виде конспекта;
- выписки из текста и др.
2) для закрепления и систематизации полученных знаний:
- анализ конспекта лекции, учебного материала;
- систематизация учебного материала посредством составления таблиц;
- составление ответов на контрольные вопросы;
- подготовка, оформление рефератов, докладов;
- составление и оформление презентаций, в том числе в электронной форме;
- выполнение заданий по образцу;
- решение задач;
- подготовка и оформление индивидуальных проектов.
Выполнение самостоятельных работ обучающихся оценивается и фиксируется в журнале учебных занятий группы на календарный учебный год.
|
КАРТА САМОСТОЯТЕЛЬНОЙ РАБОТЫ ОБУЧАЮЩЕГОСЯ | № работы | Наименование темы | Наименование самостоятельной работы (в соответствии с рабочей программой УД) | Вид работы | Форма контроля | Кол-во часов | | 1. | Тема 1.1 Основные понятия и законы химии
| Решение задач. Составление уравнений хим. реакций | Оформление в рабочей тетради. | Устная защита на занятии | 4 | | 2. | Тема 1.2 Периодический закон и Периодическая система химических элементов Д.И.Менделеева и строение атома | Письменная домашняя работа Составление электронных формул и характеристика химических элементов побочных подгрупп по их положению в периодической системе химических элементов | Оформление в рабочей тетради. | Устная защита на занятии | 4 | | 3. | Тема 1.4 Вода. Растворы. Электролитическая диссоциация | Сообщения, выступление на занятии | Оформление сообщения в тетради | Устная защита на занятии | 4 | | 4. | Тема 1.6 Химические реакции | Подбор материала для создания электронной презентации | Создание электронной презентации | Выступление на занятии с использованием презентации | 4 | | 5. | Тема 1.7 Металлы и неметаллы | Сообщения обучающих (индивидуальные задания) Тестовые задания по курсу неорганической химии | Сообщение и создание презентации | Оформление в тетради и защита устно на занятии | 2 | | 6. | Тема 2.2 Углеводороды и их природные источники | Домашняя проверочная работа Оформление презентаций в электронном виде | Оформление в тетради. Подготовка презентаций в электронном виде. | Проверка письменной работы. Защита презентаций на занятии | 10 | | 7. | Тема 2.3 Кислородсодержащие органические соединения | Подбор материала и создание электронной презентации по теме: «Применение этанола. Превращения жиров пищи в организме | Создание презентации в электронном виде | Защита презентации на занятии | 8 | | 8. | Тема 2.4 Азотсодержащие органические соединения. Полимеры | Подбор материала и создание электронной презентации по теме: «Нуклеиновые кислоты, их биологическая роль в организме», «Полимеры» | Создание презентации в электронном виде | Защита презентации на занятии | 3 | |
|
|
|
|
|
|
|
2. ПОРЯДОК ВЫПОЛНЕНИЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ОБУЧАЮЩИМСЯ
2.1 Инструкции по выполнению различных видов самостоятельных работ
1. Создание мини-проектов с представлением их в виде презентаций, выполненных в программе Microsoft PowerPoint
Проект – это целенаправленное, ограниченное по времени и ресурсам мероприятие, ориентированное на создание уникального продукта или услуги.
Основные требования к использованию метода проектов
-Наличие значимой проблемы, требующей интегрированного знания, исследовательского поиска.
-Практическая, теоретическая, познавательная значимость результатов
-Самостоятельная деятельность обучающихся.
Содержание этапов проекта
| Этап | Содержание |
| Э Этап 1. « Начальный» | В Выбор проблемы, введение в проблему, выдвижение гипотезы, постановка целей и задач поиска. Выработка плана работы |
| Э Этап 2. «Поисковый» | Р Работа в информационном поле, сбор необходимой информации по проблеме в различных источниках, анализ и структурирование собранного материала, качественная и количественная обработка собранного материала. |
| Э Этап 3. «Исследовательский » | ППроведение исследования, решение поставленной проблемы |
| Э Этап 4. «Обработка результата» | П Переработка полученных данных, анализ и редактирование полученных данных, подтверждение или отрицание выдвинутой ранее гипотезы, оформление полученных данных в виде продукта проекта |
| Э Этап 5. «Заключительный » | П Подведение итогов работы, составление письменного отчета, подготовка к публичной защите проекта в виде мультимедийной презентации. |
Мультимедийные презентации используются для того, чтобы выступающий смог на большом экране или мониторе наглядно продемонстрировать дополнительные материалы к своему сообщению: видеозапись химических и физических опытов, снимки полевых изысканий, чертежи зданий и сооружений, календарные графики замеров температуры и др. Эти материалы могут также быть подкреплены соответствующими звукозаписями.
2. Создание презентаций в электронном виде
Общие требования к презентации:
Презентация не должна быть меньше 10 слайдов.
Первый лист – это титульный лист, на котором обязательно должны быть представлены: название проекта; фамилия, имя, отчество автора; наименование учебного заведения,
Следующим слайдом должно быть содержание, где представлены основные этапы (моменты) презентации. Желательно, чтобы из содержания по гиперссылке можно перейти на необходимую страницу и вернуться вновь на содержание.
Дизайн - эргономические требования: сочетаемость цветов, ограниченное количество объектов на слайде, цвет текста.
В презентации необходимы импортированные объекты из существующих цифровых образовательных ресурсов.
последний слайд презентации должен быть список литературы.
Практические рекомендации по созданию презентаций
Создание презентации состоит из трех этапов:
I. Планирование презентации – это многошаговая процедура, включающая определение целей, изучение аудитории, формирование структуры и логики подачи материала. Планирование презентации включает в себя:
1. Определение целей.
2. Определение основной идеи презентации.
3. Подбор дополнительной информации.
4. Планирование выступления.
5. Создание структуры презентации.
6. Подготовка заключения.
II. Разработка презентации – методологические особенности подготовки слайдов презентации, включая содержание и соотношение текстовой и графической информации.
III. Репетиция презентации – это проверка и отладка созданной презентации.
Требования к оформлению презентаций
В оформлении презентаций выделяют два блока: оформление слайдов и представление информации на них. Для создания качественной презентации необходимо соблюдать ряд требований, предъявляемых к оформлению данных блоков.
Оформление слайдов:
| Стиль | - Соблюдайте единый стиль оформления - Избегайте стилей, которые будут отвлекать от самой презентации. - Вспомогательная информация (управляющие кнопки) не должны преобладать над основной информацией (текстом, иллюстрациями). |
| Фон | Для фона предпочтительны холодные тона |
| Использование цвета | - На одном слайде рекомендуется использовать не более трех цветов: один для фона, один для заголовка, один для текста. - Для фона и текста используйте контрастные цвета. - Обратите внимание на цвет гиперссылок (до и после использования). |
| Анимационные эффекты | - Используйте возможности компьютерной анимации для представления информации на слайде. - Не стоит злоупотреблять различными анимационными эффектами, они не должны отвлекать внимание от содержания информации на слайде. |
Представление информации:
| Содержание информации | - Используйте короткие слова и предложения. - Минимизируйте количество предлогов, наречий, прилагательных. - Заголовки должны привлекать внимание аудитории. |
| Расположение информации на странице | - Предпочтительно горизонтальное расположение информации. - Наиболее важная информация должна располагаться в центре экрана. - Если на слайде располагается картинка, надпись должна располагаться под ней. |
| Шрифты | - Для заголовков – не менее 24. - Для информации не менее 18. - Нельзя смешивать разные типы шрифтов в одной презентации. - Для выделения информации следует использовать жирный шрифт, курсив или подчеркивание. - Нельзя злоупотреблять прописными буквами (они читаются хуже строчных). |
| Способы выделения информации | Следует использовать: - рамки; границы, заливку; - штриховку, стрелки; - рисунки, диаграммы, схемы для иллюстрации наиболее важных фактов. |
| Объем информации | - Не стоит заполнять один слайд слишком большим объемом информации: люди могут единовременно запомнить не более трех фактов, выводов, определений. - Наибольшая эффективность достигается тогда, когда ключевые пункты отображаются по одному на каждом отдельном слайде. |
| Виды слайдов | Для обеспечения разнообразия следует использовать разные виды слайдов: - с текстом; - с таблицами; - с диаграммами.
|
3. Доклад или сообщение
Основные требования к докладу (сообщению)
Доклад – это научное сообщение на семинарском занятии, заседании студенческого научного кружка или студенческой конференции.
Существует несколько стилей изложения, например, разговорный стиль, канцелярский и т.п. Студенческий доклад должен быть изложен языком науки. Это предполагает выполнение определенных требований.
Специфика доклада как устного сообщения
Поскольку доклад – это устное выступление, он отличается от письменных работ (рефератов, курсовых и дипломных работ). Для этого нужно соблюдать определенные правила.
Во-первых, необходимо четко соблюдать регламент.
Для того чтобы уложиться в отведенное время необходимо:
а) тщательно отобрать факты и примеры, исключить из текста выступления все, не относящееся напрямую к теме;
б) исключить все повторы;
в) весь иллюстративный материал (графики, диаграммы, таблицы, схемы) должен быть подготовлен заранее;
г) необходимо заранее проговорить вслух текст выступления, зафиксировав время и сделав поправку на волнение, которое неизбежно увеличивает время выступления перед аудиторией.
Во-вторых, доклад должен хорошо восприниматься на слух.
Это предполагает:
а) краткость, т.е. исключение из текста слов и словосочетаний, не несущих смысловой нагрузки;
б) смысловую точность, т.е. отсутствие возможности двоякого толкования тех или иных фраз;
в) отказ от неоправданного использования иностранных слов и сложных грамматических конструкций.
И, наконец, главное: слушателю должна быть понятна логика изложения.
С этой целью перед тем, как закончить доклад, желательно очень кратко повторить алгоритм (ход рассуждений), с помощью которого автор пришел к окончательным выводам.
В третьих, необходимо постоянно поддерживать контакт с аудиторией.
Для того, чтобы поддерживать постоянный контакт с аудиторией, используются разнообразные ораторские приемы. Основными из них являются следующие:
а) риторические вопросы;
б) паузы;
в) голосовые приемы (понижение или повышение голоса, ускорение или замедление речи, замедленное и отчетливое произнесение некоторых слов);
г) жестикуляция;
д) прямое требование внимания
Основные критерии оценки доклада.
В качестве основных критериев оценки студенческого доклада могут выступать:
а) соответствие содержания заявленной теме;
б) актуальность, новизна и значимость темы;
в) четкая постановка цели и задач исследования;
г) аргументированность и логичность изложения;
д) научная новизна и достоверность полученных результатов;
е) свободное владение материалом;
ж) состав и количество используемых источников и литературы;
з) культура речи, ораторское мастерство;
и) выдержанность регламента.
4. Памятка-алгоритм написания конспекта
Перед конспектированием необходимо тщательно изучить конспектируемое произведение.
Конспектированию предшествует составление плана.
В начале конспекта необходимо точно указать фамилию и инициалы автора (или редактора сборника), полное название работы, место и год издания.
Наименование глав, разделов, параграфов конспектируемой работы всегда указывать точно.
Изложение текста дается сжато, но основные мысли и аргументы записываются подробно.
В конспекте можно использовать цитаты.
При оформлении конспекта используйте подчеркивания, условные знаки, пометки на полях.
Критерии оценки:
Оценка «отлично»: актуальность темы; грамотность и полнота использования источников; наличие элементов наглядности. Обучающийся четко и ясно озвучивает сообщение, а не зачитывает.
Оценка «хорошо» актуальности темы; соответствие содержания теме; грамотность и полнота использования источников; отсутствие элементов наглядности. Обучающийся четко зачитывает сообщение.
Оценка «удовлетворительно» сообщение не вполне соответствует содержанию темы; отсутствуют элементы наглядности. Обучающийся монотонно зачитывает сообщение.
5. Решение задач
Задача — это цель, заданная в определенных условиях, решение задачи — процесс достижения поставленной цели, поиск необходимых для этого средств.
Алгоритм решения задач:
1. Внимательно прочитайте условие задания и уясните основной вопрос, представьте процессы и явления, описанные в условии.
2. Повторно прочтите условие для того, чтобы чётко представить основной
вопрос, проблему, цель решения, заданные величины, опираясь на которые
можно вести поиски решения.
3. Произведите краткую запись условия задания.
4. Если необходимо составьте уравнение реакции.
5. Определите метод решения задания, составьте план решения.
6. Запишите основные понятия, формулы, описывающие процессы, предложенные заданной системой.
7. Найдите решение в общем виде, выразив искомые величины
через заданные.
8. Проверьте правильность решения задания.
9. Произведите оценку реальности полученного решения.
10. Запишите ответ.
Критерии оценки (задачи, упражнения)
Оценка «отлично» ставится за верное выполнение всего задания,
допускается 1или 2 недочёта.
Оценка «хорошо» ставится за верное выполнение 75% задания.
Оценка «удовлетворительно» ставится за верное выполнение 50% задания.
В случае выполнения менее 50% задания – оценка «неудовлетворительно».
2.2 Методические указания по выполнению самостоятельной работы
Раздел 1. Общая и неорганическая химия
Тема 1.1 Основные понятия и законы химии
Самостоятельная работа №1 Решение задач. Составление уравнений химических реакций по схемам (в двух вариантах).
Цель: Применение знаний, формирование умений.
Методические указания по выполнению самостоятельной работы
Порядок проверки, защиты самостоятельной работы: работа оформляется в рабочей тетради, защита устно в течение 14 дней
Перед выполнением работы необходимо изучить теоретический лекционный материал, знать понятия гомологи и изомеры. Знать основные понятия и законы химии. Научиться выполнять простейшие расчеты по химическим формулам
Вопросы, рекомендуемые для рассмотрения:
1. Задача 1
Какую массу будут иметь 5,6 л (н.у) углекислого газа? Сколько молекул содержит этот объём газа?
Задача 2
Какой объём займут при нормальных условиях 128 г сернистого газа? Сколько молекул будет содержать сернистый газ такой массы?
Задача 3
Рассчитайте относительную плотность по водороду следующих газов: сероводорода, хлора, аммиака, озона, метана.
Задача 4
Определите массу: 0,1 моль гидроксида натрия, 2 моль соляной кислоты, 1 моль серной кислоты.
( задачи 1 и 3 – первый вариант; задачи 2 и 4 – второй вариант)
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cl2→HCl→NaCl→AgCl - 1 вариант
Li→Li2O→LiOH→Li2CO3→CO2 - 2 вариант
Рекомендуемая литература
О1. Стр. 4 – 12; 15 - 30
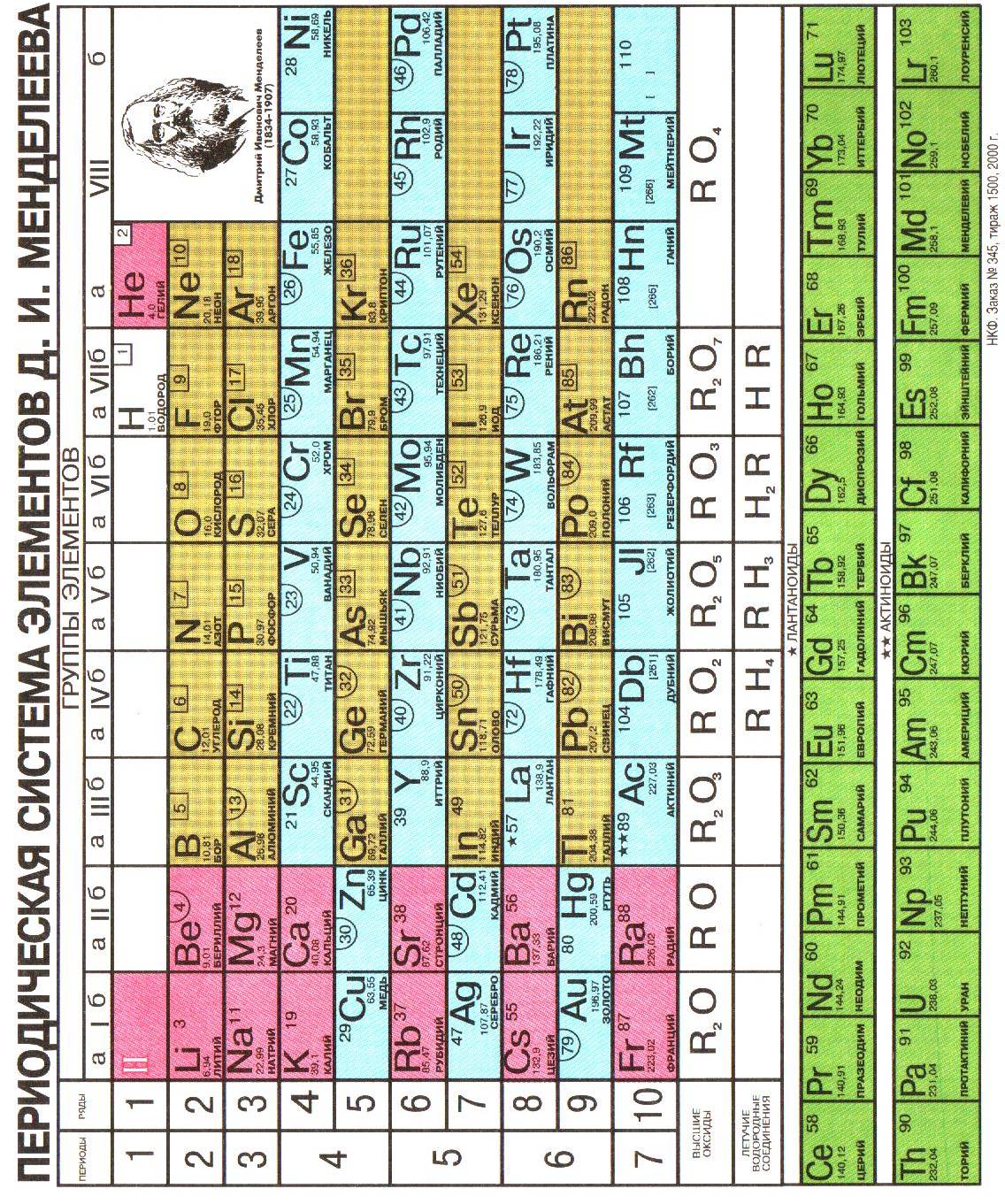
Тема 1.2 Периодический закон и периодическая система химических элементов Д.И.Менделеева и строение атома
Самостоятельная работ №2. Составление электронных формул и характеристика химических элементов побочных подгрупп по их положению в периодической системе химических элементов
Цель: Закрепление и систематизация знаний
Методические указания по выполнению самостоятельной работы
Порядок проверки, защиты самостоятельной работы: работа оформляется в рабочей тетради, защита устно в течение 14 дней.
Вспомните строение атома химических элементов и периодическую систему химических элементов: физический смысл номера периода, группы, порядкового номера.
Вопросы, рекомендуемые для рассмотрения:
Положение химического элемента в периодической системе; зависимость свойств химического элемента и его соединений от его положения в периодической системе химических элементов на примере элементов №24, 25, 26, 42, 47, 75.
(четные номера – первый вариант; нечетные – второй вариант)
План характеристики химического элемента и его соединений по положению элемента в периодической системе
I. Место элемента в периодической системе:
1. № периода, большой или малый;
2. № группы, главная или побочная подгруппа;
3. порядковый № элемента;
4. относительная атомная масса элемента (Ar).
II. Строение атома и электронных оболочек:
1. строение атома: число протонов, электронов, нейтронов;
2. строение электронных оболочек по уровням и подуровням (структура электронной оболочки):
а) валентные электроны, их графическое и схематичное строение;
б) валентность элемента в соединениях.
III. Соединения элементов и их характер:
1. формула высшего оксида, его характер (для переходных элементов формула оксида в характерной валентности);
2. формула гидроксида, его характер;
3. формула средней соли для гидроксида;
4. формула летучего водородного соединения.
IV. Сравнение элемента по характеру с соседями:
1. по группе (подгруппе);
2. по периоду.
Рекомендуемая литература
О1. Стр. 33 - 47
Конспект лекции
Тема 1.4 Вода. Растворы. Электролитическая диссоциация
Самостоятельная работа №3. Написание рефератов и подготовка сообщений обучающимися
Цель: Закрепление и систематизация знаний
Методические указания по выполнению самостоятельной работы
Порядок проверки, защиты самостоятельной работы: работа оформляется в рабочей тетради, защита устно на занятии.
Изучите теоретический материал, используя дополнительные источники и интернет ресурсы. Выпишите понятия: электролитическая диссоциация, гидролиза и его правила. Покажите примеры написания уравнений реакций электролитической диссоциации. Рассмотрите тепловые явления при растворении (обратите внимание на разбавление кислот и растворение аммиака)
Вопросы, рекомендуемые для рассмотрения:
Электролитическая диссоциация – как обратимый процесс. Реакции ионного обмена. Гидролиз солей. Типы гидролиза. Молекулярные, полные ионные и краткие ионные уравнения гидролиза. Тепловые явления при растворении.
Рекомендуемая литература
О1. Стр. 82 - 84
Интернет - ресурсы
Тема 1.6 Химические реакции
Самостоятельная работа №4 Подбор материала, составление и защита презентаций
Цель: Закрепление и систематизация знаний
Методические указания по выполнению самостоятельной работы
Порядок проверки, защиты самостоятельной работы: защита устно на занятии.
Для создания презентации изучите инструкции, по их созданию. Подберите теоретический материал, согласно теме, оформите его на слайдах. Защита в форме устного рассказа с использованием презентации на занятии.
Для выполнения заданий по окислительно-восстановительным реакциям, повторите теоретический материал по основным и дополнительным источникам, лекционным тетрадям
Вопросы, рекомендуемые для рассмотрения:
Окислители. Восстановители. Процесс окисления. Процесс восстановления. Метод электронного баланса. Значение окислительно-восстановительных реакций в жизни и народном хозяйстве
Рекомендуемая литература
О1. Стр. 56 - 60
Интернет - ресурсы
Тема 1.7 Химия металлов и неметаллов
Самостоятельная работа №5. Подготовка сообщений и создание презентаций по индивидуальным темам
Цель: Закрепление и систематизация знаний.
Методические указания по выполнению самостоятельной работы
Порядок проверки, защиты самостоятельной работы: защита устно на занятии.
Для создания презентации изучите инструкции, по их созданию. Подберите теоретический материал, согласно теме, оформите его на слайдах. Защита в форме устного рассказа с использованием презентации на занятии.
Темы сообщений индивидуальные.
Вопросы, рекомендуемые для рассмотрения:
1. Металл – химический элемент. Положение металла в Периодической системе химических элементов Д.И.Менделеева. Строение атома металла, его свойства.
2. Содержание атомов или ионов металла в живых организмах, их значение для жизни.
3. Металл – простое вещество. Физические свойства. Химические свойства.
4. Способы получения металлов – металлотермия (пирометаллургия, гидрометаллургия, электрометаллургия).
5. Применение металлов. Сплавы металлов: черные (сталь и чугун)
6. Цветные сплавы: бронза, дюралюминий, силумин, мельхиор, латунь, баббиты
7. Подберите свои примеры сплавов
Рекомендуемая литература
О1. Стр. 170 - 260
Интернет – ресурсы
Для закрепления знаний по разделу: Общая и неорганическая химия
Тестовые задания по курсу неорганической химии
Вариант №1
Какой из оксидов является несолеобразующим?
а) СО2 б) N2O в) Н2О г) Al2O3
Какая из солей является основной?
а) NaCl б) NaHSO4 в) AlOHCl2 г) NaNO2
3. Какой из перечисленных элементов образует летучее водородное соединение?
а) Ag б) О в) Fe г) Ne
Атом какого элемента имеет электронную конфигурацию внешнего уровня 2s22p3 ?
а) N б) Al в) Р г) Ва
В молекуле какого вещества присутствует ковалентная неполярная связь?
а) NaCl б) HCl в) Al г) Br2
Как называется следующий процесс, сколько электронов в нем участвует?
S+6→ S-2
а) окисление, 4е б) восстановление, 8е
в) окисление, 8е г) восстановление, 4е
Какая из следующих реакций выражается сокращенным уравнением:
2H+ + CO32- = CO2 + H2O?
а) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
б) CaCO3 + 2HCl = CaCl2 + CO2 + H2O
в) BaCO3 + 2HNO3= Ba(NO3)2 + CO2 + H2O
г) NaHCO3 + HCl = NaCl + H2O + CO2
Раствор какой соли имеет кислую реакцию?
а) Na2SiO3 б)Na3PO4 в) FeCl3 г) KNO3
9.С каким из указанных веществ реагирует алюминий?
а)H2O б) HCl в) Cl2 г)KCl
Вариант №2
Какой из оксидов является основным?
а) CaO б) CO в) P2O5 г) Al2O3
Какая из солей является кислой?
а) BaCl2 б) NaHSiO3 в) AlOHCl2 г) NaNO2
3. Какой из перечисленных элементов не образует летучее водородное соединение?
а) C б) Cl в) P г) Fe
Атом какого элемента имеет электронную конфигурацию внешнего уровня 4s2 ?
а) K б)Ca в)Cl г) Cr
В молекуле какого вещества присутствует ионная связь?
а) S8 б) NaCl в) H2O г) Fen
Как называется следующий процесс, сколько электронов в нем участвует?
Mn+2 → Mn+7
а) окисление, 5е б) восстановление, 7е
в) окисление, 8е г) восстановление, 5е
Какая из следующих реакций выражается сокращенным уравнением:
HCO3- + H+ = H2O + CO2?
а) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
б) CaCO3 + 2HCl = CaCl2 + CO2 + H2O
в) BaCO3 + 2HNO3= Ba(NO3)2 + CO2 + H2O
г) NaHCO3 + HCl = NaCl + H2O + CO2
Раствор какой соли имеет щелочную реакцию?
а) K2SO4 б)Na2S в) FeCl3 г) KNO3
9.С каким из указанных веществ реагирует Al(OH)3?
а)O2 б) NaOH в) HCl г)Fe(OH)3
Вариант №3
Какой из оксидов является кислотным?
а) СО б) Nа2O в) СО2 г) Fe2O3
Какая из солей является средней?
а)Ca(HCO3)2 б)FeOH(NO3)2 в)AlOHSO4 г)Na3PO4
3. Какой из перечисленных элементов имеет наиболее ярко выраженные металлические свойства?
а) K б) Mg в) Al г) P
Атом какого элемента имеет электронную конфигурацию внешнего уровня 3s23p5 ?
а) Cu б) Cr в) Cl г) As
В молекуле какого вещества присутствует ковалентная полярная связь?
а) HCl б) S8 в) FeO г) Al
Как называется следующий процесс, сколько электронов в нем участвует?
N-3→ N+5
а) окисление, 8е б) восстановление, 3е
в) окисление, 3е г) восстановление, 8е
Какая из следующих реакций выражается сокращенным уравнением:
Cu2+ +2OH- = Cu(OH)2?
а) CuO + H2SO4 = CuSO4 + H2O
б) CuSO4 + 2NaOH = Cu(OH)2 +Na2SO4
в) CuCl2+ H2O= CuOHCl + HCl
г) CuSO4+ K2S = CuS + K2SO4
Раствор какой соли имеет нейтральную реакцию?
а) Na2S б)Na3PO4 в)Al(NO3)3 г) KNO3
9.С каким из указанных веществ реагирует железо?
а)Na б) HCl в) S г)CO2
Вариант №4
Какой из оксидов является амфотерным?
а) СО2 б) N2O в) FeO г) Al2O3
Какая из солей является основной?
a)Ca(HCO3)2 б)Ca(NO3)2 в)FeOHSO4 г)CuSO4
3. Какой из перечисленных элементов имеет наиболее ярко выраженные неметаллические свойства?
а) Li б) Ne в) F г) C
Атом какого элемента имеет электронную конфигурацию внешнего уровня 3d14S2?
а) Cl б) K в) Р г) Sc
Какие из перечисленных веществ имеют металлическую связь?
а) С б) AlF3 в) Aln г) H2S
Как называется следующий процесс, сколько электронов в нем участвует?
S0→ S+4
а) окисление, 4е б) восстановление, 8е
в) окисление, 8е г) восстановление, 4е
Какая из следующих реакций выражается сокращенным уравнением:
CuO + 2H+ = Cu2+ + H2O
а) CuO + H2SO4 = CuSO4 + H2O
б) CuSO4 + 2NaOH = Cu(OH)2+ Na2SO4
в) CuCl2 + H2O= CuOHCl + HCl
г) CuSO4 + K2S = CuS + K2SO4
Раствор какой соли имеет кислую реакцию?
а) K2S б)K2CO3 в) CuSO4 г) CaCl2
9.С каким из указанных веществ реагирует гидроксид железа(2)?
а)NaCl б) HCl в) О2 г)NaOH
Раздел 2. Органическая химия
Тема 2.2 Углеводороды и их природные источники
Самостоятельная работа №6. Домашняя проверочная работа по алканам. Составление сообщений и создание презентаций по теме «Природные источники углеводородов» (индивидуальные задания)
Цель: Закрепление и систематизация знаний Поиск информации по теме. Чтение дополнительных источников литературы и интернет-ресурсов.
Методические указания по выполнению самостоятельной работы
Для создания презентации изучите инструкции, по их созданию. Подберите теоретический материал, согласно теме, оформите его на слайдах. Защита в форме устного рассказа с использованием презентации на семинарском занятии.
Для выполнения проверочной работы необходимо изучить теоретический материал по теме: «Алканы», обратить внимание на понятия: гомологи и изомеры.
Вопросы, рекомендуемые для рассмотрения:
1. Природный и попутный нефтяные газы.
2. Каменный уголь.
3.Нефть и продукты её переработки.
Название алканов по его структурной формуле и составление формул по названиям
1. Закончите определения
Углеводородами называют органические соединения,
Алканами называют алифатические углеводороды
Гомологический ряд – это
2. Заполните таблицу по образцу:
| Название алкана | Формула алкана | Название радикала | Формула радикала |
| метан | CH4 | метил | CH3- |
| этан |
|
|
|
| пропан | CH3CH2CH3 |
| CH3CH2CH2- |
| пропан |
| изопропил |
|
| бутан |
|
|
|
| пентан |
|
|
|
| изобутан |
|
|
|
| изопентан |
|
|
|
| гексан |
|
|
|
3 .Выберите правильный ответ. Какая формула соответствует алканам?
А) СnH2n+2 Б) СnH2n В) СnH2n-2
4. Напишите все возможные изомеры алкана C6H14 и назовите их.
5. Напишите название вещества по его структурной формуле:
| а) 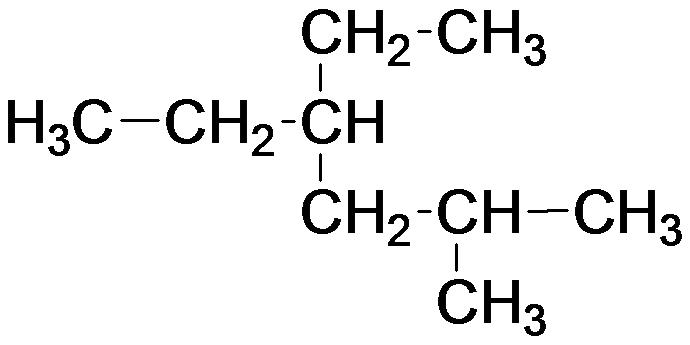 | б) 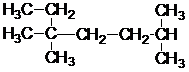
|
6. Напишите структурные формулы следующих соединений: 2,2,3-триметилгексан; 2,4-диметил-3-изопропилгептан, 2-нитропропан, тетрахлорметан.
7. Осуществите ряд превращений: CH4 → CН3СI → C2Н6 → C2Н5Вr.
8. Вычислите относительную плотность газа по воздуху (Dвозд) и по водороду(Dн2)
| Формула | Название | Dвозд. | 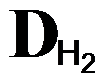
|
| СН4 |
|
|
|
| С4Н10 |
|
|
|
9 .Напишите уравнения реакций превращения этана в бутан
(CH3- CH3 → CH3-CH2-CH2-CH3).
4. Роль каучука в народном хозяйстве
Форма работы: составление опорного конспекта «Химические свойства непредельных углеводородов». Диеновые углеводороды. Каучуки
Вопросы, рекомендуемые для рассмотрения:
Реакции присоединения: гидрирование, галогенирование, гидрогалогенирование, гидратация. Реакции окисления. Реакции полимеризации. Каучуки природный и синтетические, их роль в народном хозяйстве.
5. Бензин, характеристики бензина. Октановое число
Форма работы: составление презентации по данной теме
Вопросы, рекомендуемые для рассмотрения:
Современные способы получения бензина, октановое число. Дизельное топливо, цетановое число.
Рекомендуемая литература
О1. Стр. 275-282
Д1. Стр. 14-16, 21 -22
Интернет-ресурсы
Тема 2.3 Кислородсодержащие органические вещества
Самостоятельная работа №7. Подбор материала, подготовка сообщения, оформление в виде опорного конспекта и составление презентации
Цель: Закрепление и систематизация знаний
Методические указания по выполнению самостоятельной работы
Для создания презентации изучите инструкции, по их созданию. Подберите теоретический материал, согласно теме, оформите его на слайдах. Защита в форме устного рассказа с использованием презентации на занятии.
Вопросы, рекомендуемые для рассмотрения:
Особенности химических свойств одноатомных спиртов, обусловленные строением их молекул. Реакции замещения атомов водорода; реакции этерификации; горение; дегидратация спиртов; взаимодействие с галогеноводородными кислотами. Применение этанола в народном хозяйстве. Влияние этанола на организм.
Жиры. Мыло. Синтетические моющие средства
Вопросы, рекомендуемые для рассмотрения:
Высшие карбоновые кислоты (пальмитиновая и стеариновая). Мыла – жидкие и твердые. Понятия о синтетических моющих средствах.
Рекомендуемая литература
О1. Стр. 307 – 310, 333-337
Д1. Стр. 76 – 84, 117-122
Интернет - ресурсы
Тема 2.4 Азотсодержащие органические вещества
Самостоятельная работа №8 Подготовка сообщений по теме «Амины. Аминокислоты. Белки» (индивидуальная работа по вариантам)
Составление таблицы «Основные классы органических соединений»
Цель: Поиск информации по теме. Чтение дополнительной литературы. Применение знаний и умений. Систематизация знаний.
Методические указания по выполнению самостоятельной работы
Для создания презентации изучите инструкции, по их созданию. Подберите теоретический материал, согласно теме, оформите его на слайдах. Защита в форме устного рассказа с использованием презентации на занятии.
Для составления таблицы по основным классам органических соединений, вспомните функциональные группы спиртов, альдегидов, карбоновых кислот, эфиров, аминов. Обратите внимание на характерные свойства различных классов, свяжите их со строением
Вопросы, рекомендуемые для рассмотрения:
Подготовка сообщений по вариантам:
Вариант 1. Амины. Классификация и изомерия аминов. Гомологический ряд предельных аминов. Физические свойства аминов
Вариант 2. Получение предельных аминов. Химические свойства предельных аминов
Вариант 3. Ароматические амины. Анилин. Физические свойства и получение ароматических аминов. Химические свойства на примере анилина
Вариант 4. Аминокислоты, их строение, классификация и номенклатура. Получение аминокислот
Вариант 5. Химические свойства аминокислот. Биологическая роль аминокислот. Пептиды
Вариант 6. Белки. Структура белков. Физические и химические свойства белков. Синтез белков. Биологическое значение
Вариант 7. Нуклеиновые кислоты, их биологическая роль в организме
2). Основные классы органических соединений; функциональные группы; характерные виды химических свойств
Рекомендуемая литература
О1. Стр. 346 - 364
Д2. Стр. 5 - 24
Интернет – ресурсы
Рекомендуемые источники информации
Основные источники:
Ерохин Ю. М. Химия для профессий и специальностей технического и естественно - научного профилей: учебник для студ. учреждений сред. проф. образования – М.: Академия, 2015 – 448 с. [Электронный ресурс; Режим доступа http://www.academia-moscow.ru]
Никольский, А. Б. Химия : учебник и практикум для СПО / А. Б. Никольский, А. В. Суворов. — 2-е изд., перераб. и доп. — М. : Издательство Юрайт, 2019. — 507 с. — (Профессиональное образование) [Электронный ресурс; Режим доступа https://www.biblio-online.ru]
Коровин Н. В. Общая химия: учеб. для студ. учреждений высш. образования - М.: Академия, 2014 – 496 с. [Электронный ресурс; Режим доступа http://www.academia-moscow.ru]
Дополнительные источники:
Рудзитис Г. Е. Химия. 11 класс: учебник для образовательных организаций: базовый уровень – М.: Просвещение, 2014 – 224 с.
Свердлова Н. Д. и др. Химия: Справочник для школьников и поступающих в вузы. Курс подготовки к ГИА (ОГЭ И ГВЭ), ЕГЭ и дополнительным вступ. Испытаниями в вузы – М.: АСТ-ПРЕСС КНИГА, 2016 – 576 с.
Каврдакова Л.А., Шакирова Р. Х. БД.06 Химия. Методические указания к практическим работам для обучающихся образовательных учреждений среднего образования очной формы обучения технических специальностей - Нижневартовск: ННТ (филиал) ФГБОУ ВО «ЮГУ», 2016
ПРИЛОЖЕНИЕ 1
Электрохимический ряд напряжений
| ←←←← Возрастает восстановительная активность атомов ←←←←
|
| K | Ba | Ca | Na | Mg | Al | Zn | Cr | Fe | Sn | Pb | H | Cu | Ag | Hg | Au |
|
→→→→ Возрастает окислительная активность ионов →→→→
|
| Приложение 2 |
|
| Приложение 3 | РАСТВОРИМОСТЬ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ В ВОДЕ | Катионы | Cu2+ | Н | Р | Р | Х | Н | Х | Р | Н | Х | - | Р | р - растворимое вещество (более 1 г в 100 г воды); м - малорастворимое (от 0,01 до 1 г в 100 г воды); н – практически нерастворимые (менее 0,01 г в 100 г воды); «‑- » -вещество существует, но не может быть получен с помощью реакций обмена в водных растворах; х – вещество не существует ↑ - вещество выделяется в виде газа или распадается с выделением газа
|
|
| Sn2+ | Н | Р | Р | М | Н | Х | Р | Н | Х | - | - |
|
| Pb2+ | Н | М | М | Н | Н | Н | Н | Н | Н | - | Р |
|
| Hg2+ | Х | Р | Р | М | Н | Х | - | Н | Х | Х | Р |
|
| Ag+ | Х | Н | Н | Н | Н | Н | М | Н | Н | Х | Р |
|
| Zn2+ | Н | Н | Н | Р | Н | Н | Р | Н | Н | - | Р |
|
| Mn2+ | Н | Р | Р | Р | Н | Н | Р | Н | Н | - | Р |
|
| Co2+ | Н | Р | Р | Р | Н | Н | Р | Н | Н | - | Р |
|
| Ni2+ | Н | Р | Р | Р | Н | Н | Р | Н | Н | - | Р |
|
| Fe3+ | Н | Р | Р | Х | Н | Х | Р | Н | Х | - | Р |
|
| Fe2+ | Н | Р | Р | Р | Н | Н | Р | Н | Х | - | Р |
|
| Cr3+ | Н | Р | Р | Р | - | Х | Р | Н | Х | - | Р |
|
| Al3+ | Н | Р | Р | Р | - | Х | Р | Н | Х | - | Р |
|
| Mg2+ | Н | Р | Р | Р | - | Н | Р | Н | Н | - | Р |
|
| Ca2+ | М | Р | Р | Р | - | Н | М | Н | Н | Н | Р |
|
| Ba2+ | Р | Р | Р | Р | -‑ | Н | Н | Н | Н | Н | Р |
|
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Х | Р |
|
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
| H+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р |
|
|
|
| Анионы | OH- | Cl- | Br- | I- | S2- | SO32- | SO42- | PO43- | CO32- | SiO32- | NO3- |
|
4
4