
Урок Химии
Тема « Одноатомные предельные спирты»
Подыбайло А.П.
Преподаватель общеобразовательных дисциплин ГБОУ СПО«Муравленковский многопрофильный колледж»

Содержание:
- Классификация спиртов
- Определение. Общая формула
- Правило
- Гомологический ряд
- Модели молекул
- Физические свойства
- Химические свойства
- Безопасность
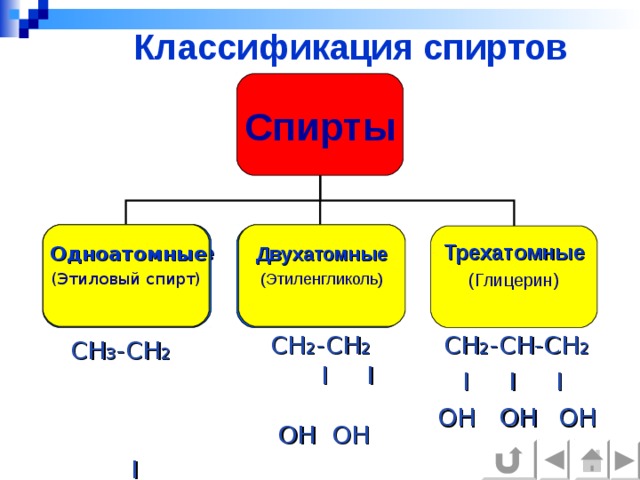
Классификация спиртов
Спирты
Одноатомные
(Этиловый спирт)
Одноатомные
(Этиловый спирт)
Одноатомные
(Этиловый спирт)
Двухатомные
(Этиленгликоль)
Двухатомные
(Этиленгликоль)
Трехатомные
(Глицерин)
Двухатомные
(Этиленгликоль)
Одноатомные
(Этиловый спирт)
CH 2 - CH 2 I I OH OH
CH 2 - CH-CH 2
I I I
OH OH OH
CH 3 -CH 2 I OH

Предельными одноатомными спиртами называются органические соединения, содержащие гидроксильную группу – ОН, соединенную с углеводородным радикалом
Общая формула предельных одноатомных спиртов
С n H 2n+1 OH

Запомни!
Названия спиртов (алкан ол ов) по систематической номенклатуре строятся из названий соответствующих алканов путём добавления суффикса «ол»

Алканолы образуют гомологический ряд общей формулы CnH 2 n+1OH ( n= 1,2,3,: N) .
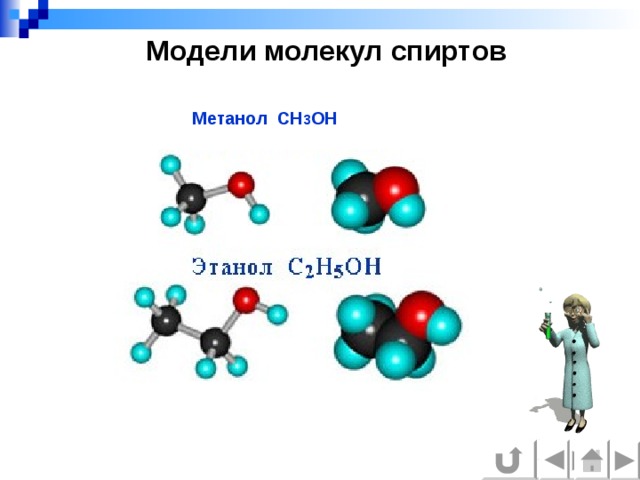
Модели молекул спиртов
Метанол СН 3 ОН

Физические свойства
спирты хорошо растворимы в воде, но с повышением количества атомов углерода растворимость спиртов уменьшается
спирты легче воды
спирты с количеством атомов
С1 – С11 - жидкости, а с С12 – твёрдые вещества
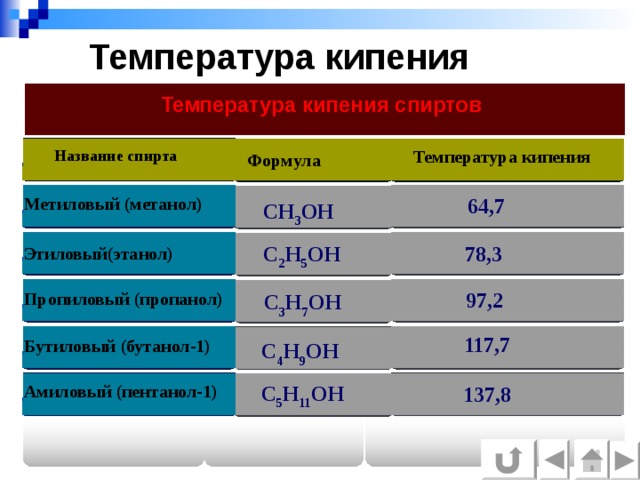
Температура кипения
Температура кипения спиртов
Название спирта
Температура кипения
Формула
64,7
Метиловый (метанол)
СН 3 ОН
С 2 Н 5 ОН
78,3
Этиловый(этанол)
97,2
Пропиловый (пропанол)
С 3 Н 7 ОН
117,7
Бутиловый (бутанол-1)
С 4 Н 9 ОН
С 5 Н 11 ОН
Амиловый (пентанол-1)
137,8

Химические свойства
1. Взаимодействие спиртов с активными металлами:
2С 2 Н 5 О Н + 2 Nа → 2 С 2 Н 5 О Nа + Н 2 ↑
этанол этилат натрия
Образующиеся при этом металлические производные спиртов называются алкоголятами .

Химические свойства
2. Взаимодействие с галогеноводородами :
- 2. Взаимодействие с галогеноводородами :
C 2 H 5 OH + H Br C 2 H 5 Br + H 2 O
этанол бромо- бромэтан
водород
При этом образуются галогенопроизводные углеводородов


Химические свойства
3. Горение: t С 2 Н 5 ОН + 3 О 2 → 2 СО 2 ↑ + 3 Н 2 О
Кислородсодержащие органические вещества горят на воздухе или в кислороде с образованием паров воды и углекислого газа .
Горение спиртов – экзотермическая
реакция, поэтому они могут быть использованы в качестве высококалорийного топлива.
![Химические свойства 4 . Окисление этилового спирта до альдегида: C 2 H 5 OH + [O] CH 3 CHO + H 2 O Появляется специфический, неприятный запах ацетальдегида](https://fsd.multiurok.ru/html/2017/10/28/s_59f43079c0141/img13.jpg)
Химические свойства
4 . Окисление этилового спирта до альдегида:
C 2 H 5 OH + [O] CH 3 CHO + H 2 O
Появляется специфический, неприятный запах ацетальдегида
 CH 2 =CH 2 + H 2 O H OH этилен этанол " width="640"
CH 2 =CH 2 + H 2 O H OH этилен этанол " width="640"
Химические свойства
1. Взаимодействие с активными металлами:
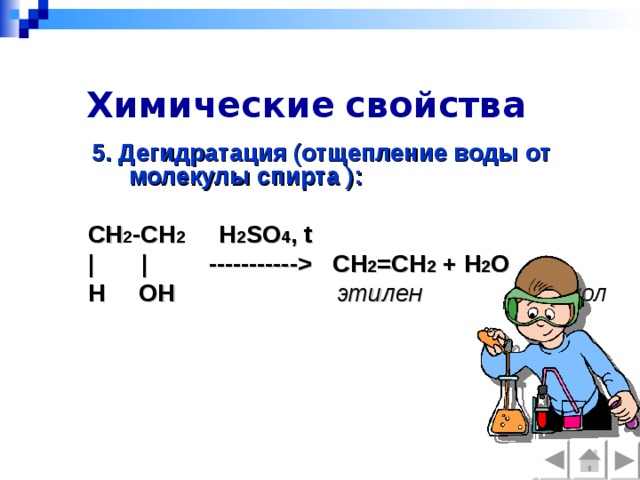
5. Дегидратация (отщепление воды от молекулы спирта ):
CH 2 -CH 2 H 2 SO 4 , t
| | ----------- CH 2 =CH 2 + H 2 O
H OH этилен этанол

Безопасность Токсичность
Метанол — ЯД! Попадание 5-10 мл метанола вызывает паралич зрения, а доза в 30 мл и больше вызывает смерть
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта.
Этанол.
Влияние алкоголя
на здоровье человека
замедляет работу центральной нервной системы, нарушает работу мозга
алкоголь вызывает ожирение сердца, разрушает эритроциты, способствует развитию гипертонии
этанол проникает в яйцеклетки и сперматозоиды, нарушая генетические структуры (гены)
стимулирует производство мочи (вследствие этого клетки обезвоживаются)
вызывает цирроз печени
Берегите здоровье!

Спасибо за внимание!!!

Использованные ресурсы
- http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Methanol-3D-balls.png (3 D структурная формула метанола)
- http://commons.wikimedia.org/wiki/File:Ethanol-3D-balls.png?uselang=ru (3 D структурная формула этанола)
- Габриелян О.С.Химия:учеб.для студ.сред.проф.учеб.заведений.М.:«Академия»,2009.
- http://school-collection.edu.ru/catalog/rubr/528b6fb1-98e4-9a27-5ae1-2f785b646a41/23867/?interface=themcol (видео опыты -Постановка опыта и текст – к.п.н. Павел Беспалов. )




















![Химические свойства 4 . Окисление этилового спирта до альдегида: C 2 H 5 OH + [O] CH 3 CHO + H 2 O Появляется специфический, неприятный запах ацетальдегида](https://fsd.multiurok.ru/html/2017/10/28/s_59f43079c0141/img13.jpg)
 CH 2 =CH 2 + H 2 O H OH этилен этанол " width="640"
CH 2 =CH 2 + H 2 O H OH этилен этанол " width="640"






















