Просмотр содержимого документа
«Основания и их свойства»
19.11.2020
Тема: Основания и их свойства
Гидроксиды - сложные соединения, в состав которых входит одна или несколько гидроксогрупп (OH−), связанных с атомом элемента.
Основания (гидроксиды) - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН.
НОМЕНКЛАТУРА ГИДРОКСИДОВ
Наличие гидроксогруппы отражается и в названии гидроксидов:
NaOH - гидроксид натрия
Ca(OH)2– гидроксид кальция
Al(OH)3 - гидроксид алюминия
Если элемент имеет несколько степеней окисления и образует несколько гидроксидов, в названии обязательно указывается его валентность:
Cr(OH)2 – гидроксид хрома (II) Fe(OH)2 – гидроксид железа (II)
Cr(OH)3 –гидрокисд хрома (III) Fe(OH)3 – гидроксид железа (III)
Классификация оснований
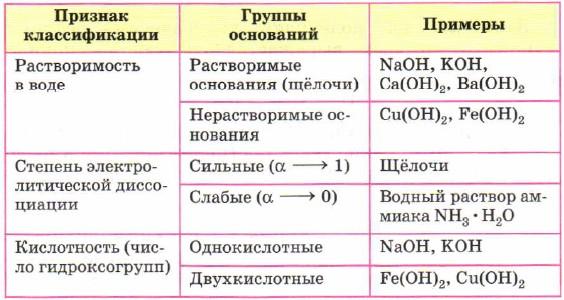
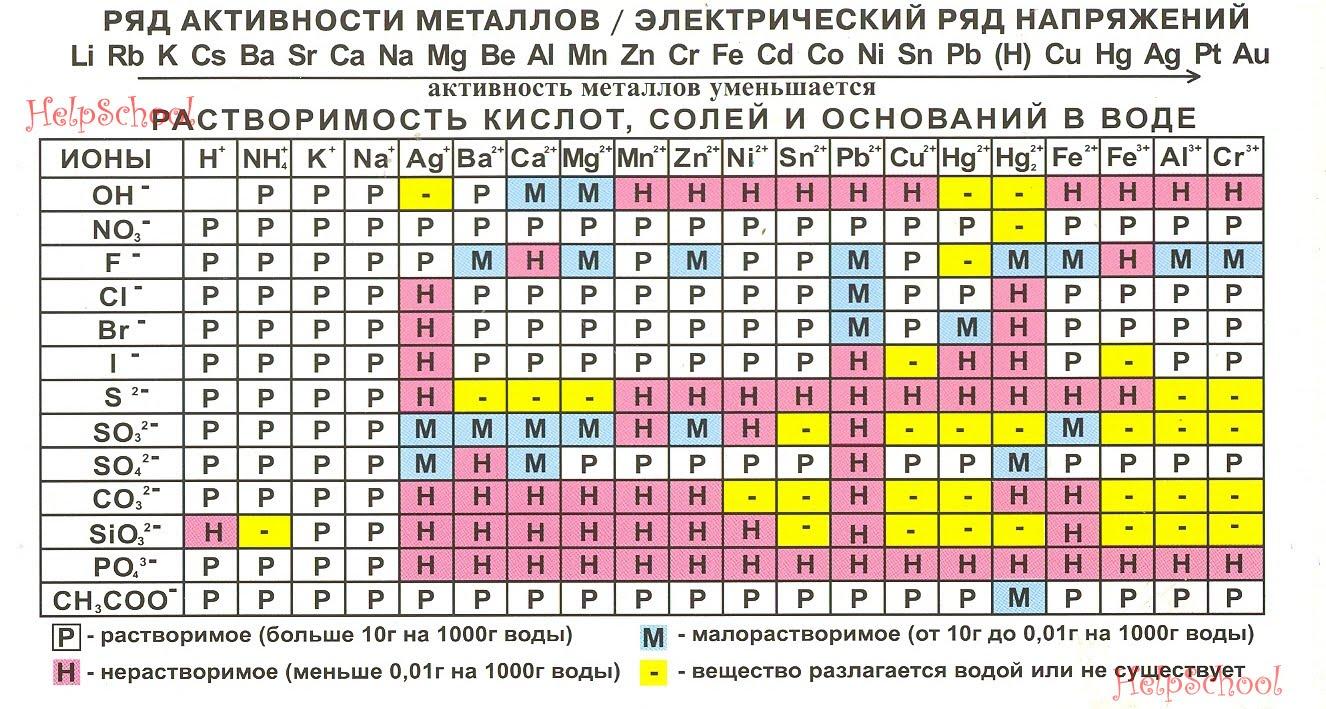
Таблица растворимости
Свойства оснований
Физические свойства оснований
твердые кристаллические вещества, растворимые в воде. Их растворы мылки на ощупь. Гидроксиды щелочных металлов (NaOH, KOH) гигроскопичны (поглощают из воздуха водяные пары и расплываются). Щелочи вызывают сильные химические ожоги при попадании на кожу или в глаза,поэтому при работе с ними
требуется жесткое соблюдение правил безопасности: работать с концентрированными растворами щелочей следует работать аккуратно, обязательно использовать защитные очки.  При попадании щелочи на кожу следует обработать пораженный участок разбавленным раствором слабой кислоты (уксусной или борной), а затем промыть большим количеством воды.
При попадании щелочи на кожу следует обработать пораженный участок разбавленным раствором слабой кислоты (уксусной или борной), а затем промыть большим количеством воды.
выпадают из в виде студенистых аморфных осадков, которые со временем кристаллизуются. Часто имеют переменный состав. Гидроксиды многих переходных металлов (железа, меди, никеля) ярко окрашены. ( Co(OH)2, Cu(OH)2)

Al(OH)3
Химические свойства оснований
Химические свойства растворимых и нерастворимых оснований сильно различаются, поэтому рассматривать их лучше в сравнении:
| Щелочи | Нерастворимые основания |
| Изменение окраски индикторов |
| фенолфталеин - малиновый метилоранж - оранжевый лакмус- синий универсальный индикатор - от синего до фиолетового | не меняют |
| Взаимодействие с кислотами |
| (реакция нейтрализации) | растворение нерастворимых гидроксидов |
| 2NaOH+H2SO4=Na2SO4+2H2O | Cu(OH)2+2HNO3=Cu(NO3)2+2H2O |
| Взаимодействие с кислотными оксидами |
| SO2+2KOH=K2SO3+H2O | − |
| Взаимодействие с солями |
| Средними (правило Бертолле): 2NaOH+MgSO4=Mg(OH)2↓+Na2SO4 кислыми: NaHCO3+NaOH=Na2CO3+H2O | − |
| Разложение при нагревании |
| Из гидроксидов щелочных металлов разлагается только гидроксид лития:
2LiOH→800∘C,H2Li2O+H2O Расплавы всех щелочноземельных металлов также разлагаются на соответствующий оксид и воду: Ca(OH)2→520−560∘C CaO+H2O
Sr(OH)2→520−560∘C SrO+H2O
Ba(OH)2→780−800∘C BaO+H2O
| Cu(OH)2=CuO+H2O |
| Взаимодействие с неметаллами |
| 2NaOH(конц., хол.)+Cl2=NaClO+NaCl+H2O 6NaOH(конц., гор.)+3Cl2=NaClO3+5NaCl+3H2O | − |
Методы получения оснований
электролиз водных растворов солей активных металлов:
2NaCl+2H2O=2NaOH+H2↑+Cl2↑

В ходе электролиза солей металлов, стоящих в ряду напряжения до алюминия, на катоде происходит восстановление воды с выделением газообразного водорода и гидроксид-ионов. Катионы металла, образованные в ходе диссоциации соли, образуют с полученными гидроксид-ионами основания.
взаимодействие металлов с водой:
2Na+2H2O=2NaOH+H2↑
Этот метод не находит практического применения ни в лаборатории, ни в промышленности. 
взаимодействие оксидов с водой:
CaO+H2O=Ca(OH)2
обменные реакции (можно получать и растворимые и нерастворимые основания):
Ba(OH)2+K2SO4=2KOH+BaSO4↓
CuCl2+2NaOH=Cu(OH)2↓+2NaNO3










 При попадании щелочи на кожу следует обработать пораженный участок разбавленным раствором слабой кислоты (уксусной или борной), а затем промыть большим количеством воды.
При попадании щелочи на кожу следует обработать пораженный участок разбавленным раствором слабой кислоты (уксусной или борной), а затем промыть большим количеством воды.












