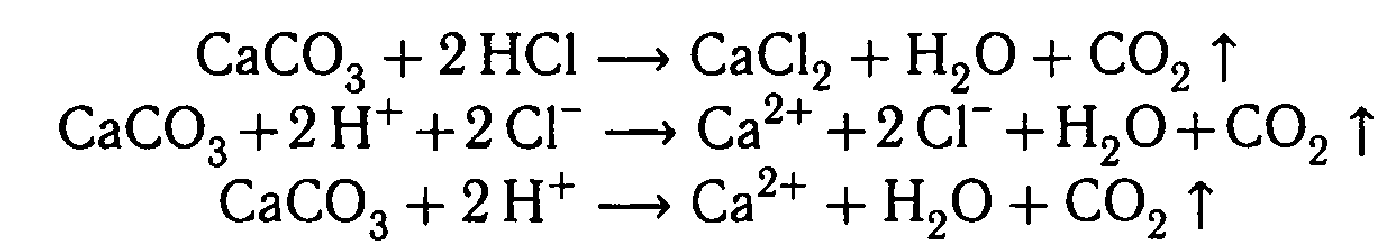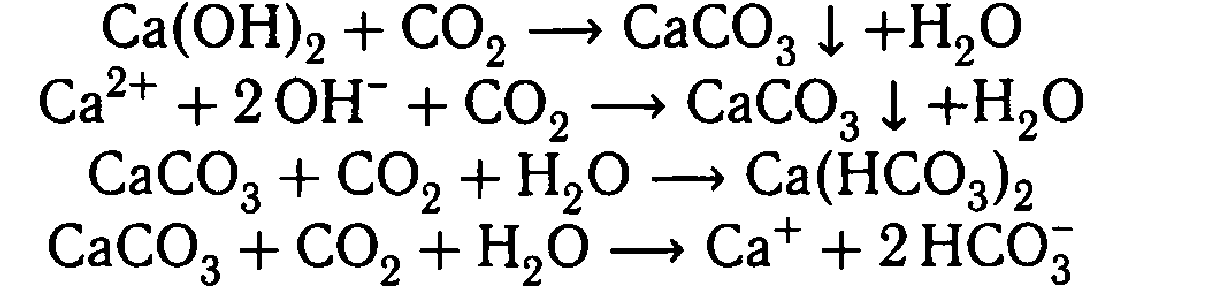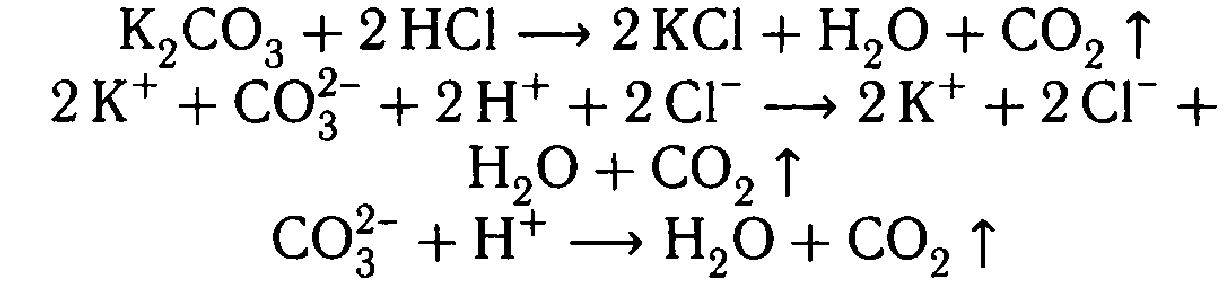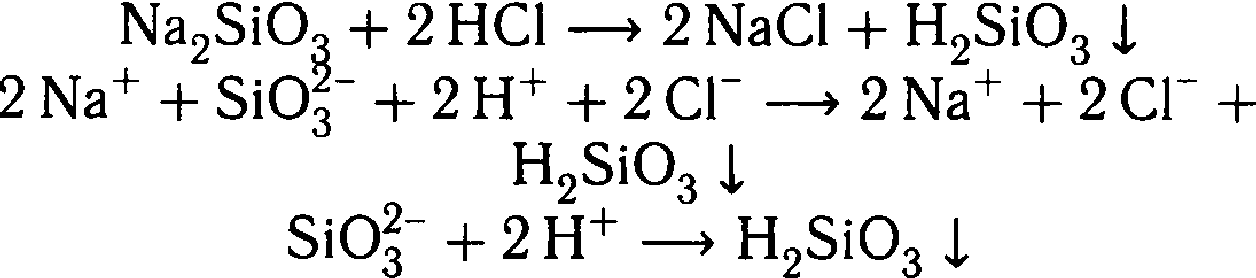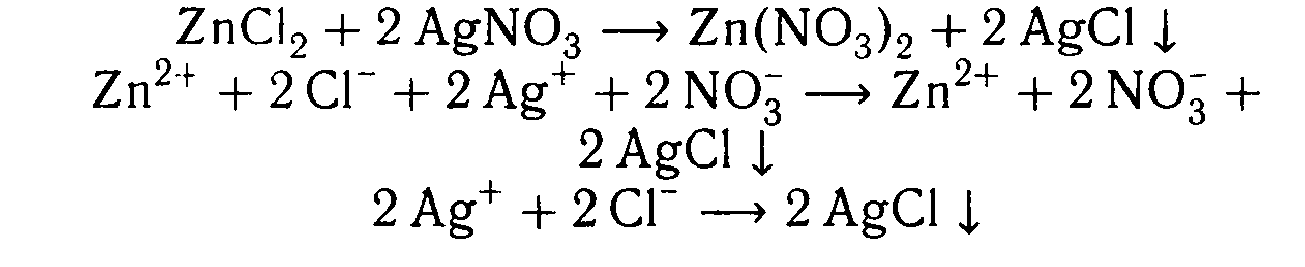| Что делали | Что наблюдали | Уравнения реакции
| Выводы |
| 1.Получение оксида углерода (IV) и определение его свойств |
| 1.Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты | Выделение газа
| CaCO3 + HCl = CaCl2 +CO2 ↑+H2O |
| | CaCO3 +2H+ → Ca2+ + CO2↑ + H2O | |
|
|
| При воздействии соляной кислоты на мрамор выделяется углекислый газ |
| 2. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2-3 мл известковой воды | Помутнение раствора
| CO2 + Ca(OH)2 = CaCO3 ↓+ H2O | Образуется нерастворимое вещество карбонат кальция |
| 3. Пропускаем углекислый газ еще некоторое время | Раствор становится прозрачным | CaCO3 + CO2 + H2O = Ca(HCO3)2 | При пропускании углекислого газа через известковую воду образуется карбонат кальция, который затем растворяется, превращаясь в гидрокарбонат |
| 4. Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Затем поместите трубку в пробирку с 2-3 мл дистиллированной воды и пропустите через неё газ. Через несколько минут выньте трубку из раствора, внесите в полученный раствор универсальную индикаторную бумагу (синий лакмус)
| Лакмус краснеет
| H2CO3 ↔CO2↑ + H2O | В воде образуется слабая угольная кислота
|
| 5.В пробирку налейте 2-3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ
| Малиновая окраска исчезает, раствор становится прозрачным |
CO2 +2NaOH = Na2CO3 + H2O | Идет реакция между CO2 и NaOH
Это еще раз подтверждает кислотные свойства
CO2
|
| 2.Распознавание карбонатов |
| В четырёх пронумерованных пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке. Na2SO4, ZnCl2, K2CO3, Na2SiO3 |
| В каждую из пробирок добавляем раствор соляной кислоты -
Na2SO4 + HCl = -
ZnCl2 + HCl = -
K2CO3 + HCl = -
Na2SiO3 + HCl = | В двух пробирках ничего не изменилось, в одной из пробирок выделился газ, в другой студенистый осадок | 3) K2CO3 + HCl = KCl + H2O + CO2↑
4) Na2SiO3 + HCl = 2NaCl + H2SiO3↓ | Выделение газа при действии кислоты - признак карбонатов
Студенистый осадок – образовалась нерастворимая кремниевая кислота |
| Два оставшихся вещества растворяем водой и добавляем раствор хлорида бария 1)Na2SO4 + BaCl2 = 2)ZnCl2 + BaCl2 =
|
1) Выпал белый осадок
|
1)Na2SO4 + BaCl2 = BaSO4 ↓+ 2NaCl
| Это качественная реакция на сульфат-ион, значит, в данной пробирке находится сульфат натрия |
| В оставшийся раствор добавляем раствор нитрата серебра (I) | 2) Выпал белый осадок | 2)ZnCl2 + 2AgNO3 = 2AgCl ↓+ Zn(NO3)2 | Реакция является качественной на хлорид-ион, в данной пробирке - хлорид цинка |
| Вывод: качественной реакцией на карбонат-ион является действие сильной кислоты, которая вытесняет слабую кислоту из раствора ее соли, происходит выделение углекислого газа. |
|