
Амфотерность
Амфотерные оксиды и гидроксиды

Что такое амфотерность?
Амфотерность - это способность вещества взаимодействовать как с кислотными по свойствам веществами, так и с основными Таким образом, невозможно данные вещества отнести полностью к кислотным или основным
ВОДА КАК АМФОТЕРНОЕ ВЕЩЕСТВО
Взаимодействие с основным оксидом натрия
Взаимодействие с кислотным оксидом серы (VI)

Еще примеры амфотерных веществ
- Металлы с валентностями III, IV + цинк (Zn) + бериллий (Be)
- Оксиды данных металлов, например, ZnO
- Гидроксиды данных металлов, Fe(OH) 3
Al
Zn

Амфотерные металлы
Физические свойства амфотерных металлов не позволяют отличить их от неамфотерных:
- металлический блеск
- ковкость
- высокая теплопроводность
- металлическая кр.решетка
- электропроводность
- высокая температура плавления/кипения
Другими словами, амфотерные металлы, их оксиды и гидроксиды - группа веществ с атомами Ме, способная взаимодействовать с основными веществами
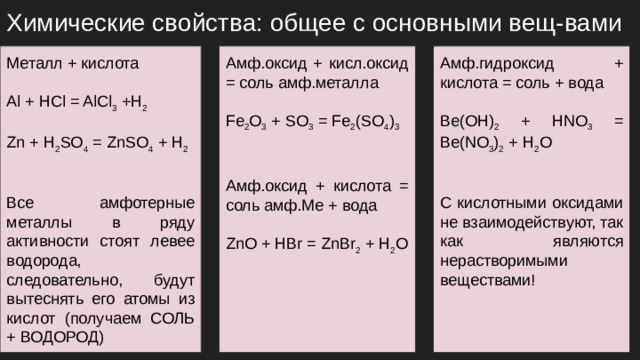
Химические свойства: общее с основными вещ-вами
Амф.оксид + кисл.оксид = соль амф.металла
Амф.гидроксид + кислота = соль + вода
Металл + кислота
Be(OH) 2 + HNO 3 = Be(NO 3 ) 2 + H 2 O
Fe 2 O 3 + SO 3 = Fe 2 (SO 4 ) 3
Al + HCl = AlCl 3 +H 2
Zn + H 2 SO 4 = ZnSO 4 + H 2
Амф.оксид + кислота = соль амф.Ме + вода
С кислотными оксидами не взаимодействуют, так как являются нерастворимыми веществами!
Все амфотерные металлы в ряду активности стоят левее водорода, следовательно, будут вытеснять его атомы из кислот (получаем СОЛЬ + ВОДОРОД)
ZnO + HBr = ZnBr 2 + H 2 O

Химические свойства: общее с кислотными веществами
Есть 2 типа взаимодействия с основными веществами (оксидами и гидроксидами): реакция в растворах и в расплавах
В растворе:
Образуется комплексная соль - тетрагидроксоаллюминат натрия

Химические свойства: общее с кислотными веществами
В расплаве:
Образуются безводные соли - алюминат натрия или цинкат натрия
(AlO2) и (ZnO2) - это кислотные остатки в данных солях

Возможные реакции
Металл + щелочь (раствор) = комплексная соль
Металл + щелочь (расплав) = безводн.соль + водород
Оксид амф. + оксид осн. (расплав) = безводн.соль
Гидроксид амф. + гидроксид осн. (раствор) = комплексная соль
Гидроксид амф. + гидроксид осн. (расплав) = безводная соль + вода


































