
«Их получают путем горения Или сложных веществ разложения. В них два элемента, один – кислород. Я отнесу к ним и известь, и лед»

«Оксиды. Номенклатура, классификация, физические свойства»

План урока.
- Определение оксидов
- Номенклатура
- Физические свойства оксидов
- Классификация оксидов
- Способы получения оксидов
- Домашнее задание

Оксидами называются сложные вещества, состоящие из 2-х элементов, один из которых кислород со степенью окисления -2 .
H2O; KI; HCI; HNO3
- Алюминий кислородович -
- Калий кислородович –
- Сера трикислородовна -
CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3

Правильные названия оксидов
CO2 - оксид углерода ( IV)
FeO - оксид железа ( II)
CO - оксид углерода ( II)
SO3 - оксид серы ( VI)
N2O5 - оксид азота ( V)
K2O - оксид калия
SO2 - оксид серы ( IV)
CaO - оксид кальция
Fe2O3 - оксид железа ( III)

Физические свойства оксидов
Широка натура у оксидов,
Камнем вниз(…) а то рекой течет (…),
А захочет – газ различных видов (…),
И веществ создаст круговорот (…).
Может черным быть (…), и белым (…),
Может с запахом (…) и без (…),
Не оставит вас без дела:
«Изучайте – мир чудес!»

Физические свойства оксидов
Широка натура у оксидов,
Камнем вниз ( CuO , CaO ), а то рекой течет ( H 2 O ),
А захочет – газ различных видов ( CO 2, SO 2 ),
И веществ создаст круговорот ( CO 2, H 2 O , SO 3 ) .
Может черным быть ( CuO ), и белым ( CaO ),
Может с запахом ( SO 2 ) и без ( CO 2 ),
Не оставит вас без дела:
«Изучайте – мир чудес!»
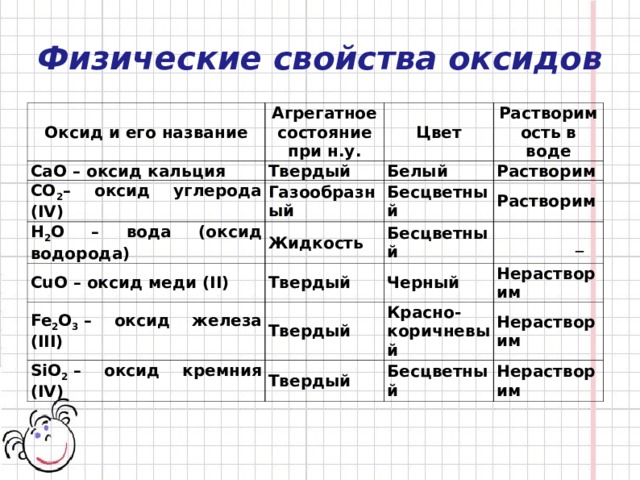
Физические свойства оксидов
Оксид и его название
Агрегатное состояние при н.у.
CaO – оксид кальция
Твердый
CO 2 – оксид углерода (IV)
Цвет
Растворимость в воде
Белый
Газообразный
H 2 O – вода (оксид водорода)
Растворим
Жидкость
CuO – оксид меди (II)
Бесцветный
Fe 2 O 3 – оксид железа (III)
Бесцветный
Твердый
Растворим
Твердый
_
Черный
SiO 2 – оксид кремния (IV)
Нерастворим
Красно-коричневый
Твердый
Нерастворим
Бесцветный
Нерастворим
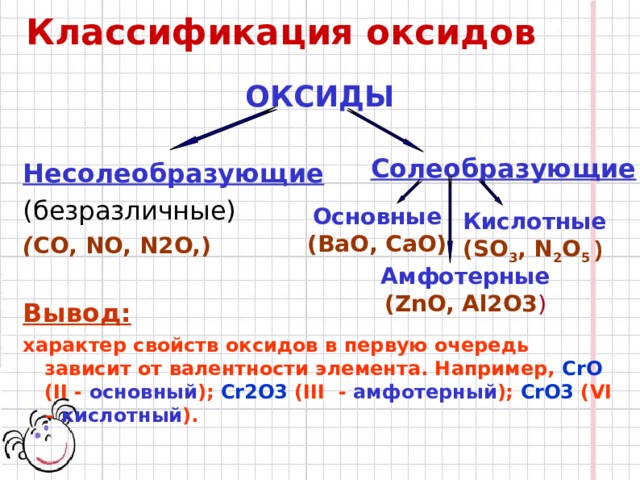
Классификация оксидов
ОКСИДЫ
Несолеобразующие
(безразличные)
( СО, NO, N 2 O, )
Вывод:
характер свойств оксидов в первую очередь зависит от валентности элемента. Например, CrO ( II - основный ); Cr2O3 ( III - амфотерный ); CrO3 ( VI – кислотный ).
Солеобразующие
Основные
(ВаО, СаО)
Кислотные
( SO 3 , N 2 O 5 )
Амфотерные
( ZnO, Al2O3 )

ЭхО y
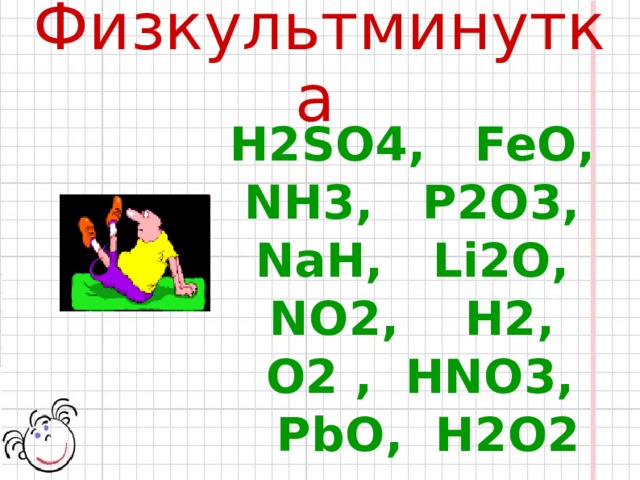
Физкультминутка
Н2SO4, Fe О,
NН3, P 2О3,
NaН, Li 2О,
N O2, Н2,
О2 , НNО3,
PbO , H2O2

Способы получения оксидов
2. Термическое разложение оснований, солей, кислот:
CaCO 3 = CaO + CO 2
2H 3 BO 3 = B 2 O 3 + H 2 O
Mg(OH) 2 = MgO + H 2 O
1. Взаимодействие простых веществ с кислородом:
S+O 2 = SO 2
4Al + 3O 2 = 2Al 2 O 3
Так получают, преимущественно, оксиды неметаллов
3. Взаимодействие простых веществ и солей с кислотами-окислителями :
С + 4HNO 3 (p-p) =O 2 + 4NO 2 + H 2 O
Cu + 4HNO 3 ( конц .) = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O
Na 2 SO 3 + 2H 2 SO 4 = 2NaHSO 4 + SO 2 + H 2 O
Так получают, преимущественно, оксиды неметаллов.

Синквейн - это творческая работа, которая имеет короткую форму стихотворения, состоящего из пяти нерифмованных строк .
Синквейн – это не простое стихотворение, а стихотворение, написанное по следующим правилам:
1 строка – одно существительное , выражающее главную тему cинквейна.
2 строка – два прилагательных , выражающих главную мысль.
3 строка – три глагола , описывающие действия в рамках темы.
4 строка – фраза , несущая определенный смысл.
5 строка – слово-резюме в форме существительного, характеризующее суть предмета или объекта .

Пример синквейна
Оксид меди -
- Чёрный, твёрдый
- Не растворяется, не испаряется, не используется в пищу
- Сложное химическое соединение
- Медь оксидовна !

Темы синквейнов
- Углекислый газ
- Угарный газ
- Сернистый газ
- Оксид железа ( II )
- Оксид железа ( III )
- Песок
- Гашёная известь
- Оксид алюминия
- Оксид серы (VI)
- Вода

Творческое задание
Оксиды в руках художника становятся пигментами красок.
Обязательными компонентами краски являются окрашивающее вещество – пигмент и связующее.
Вам предлагаются цвета красок (зеленый, белый, желтый, синий, оранжевый, коричневый) определите, какой из оксидов является пигментом.
Исследовательскую работу оформите по плану.
1. Определите, какой оксид является пигментом данного цвета.
2. Составьте формулу оксида, дать ему характеристику.
3. Область применения таких красок.
4. Получение оксида – пигмента.
5. Представьте картину(-ы) известных художников, где ярко выражено использование красок, в состав которых входит рассматриваемый пигмент.

Закончите предложения
1. Меня удивило…. 2 . Я задумался… 3 . У меня возник вопрос…

Домашнее задание
Прочесть § 41
с. 248-249, упр. №1 после параграфа
Дополнительные творческие задания (на выбор).

Спасибо за внимание !



































