Просмотр содержимого документа
«Презентация на тему " Амфотерные оксиды и гидроксиды"»

ТЕМА: АМФОТЕРНЫЕ ОКСИДЫ И ГИДРОКСИДЫ

Вещества - « хамелеоны ».
При добавлении к таким веществам кислоты, они проявляют основные свойства, а при добавлении к ним щелочи – кислотные свойства.
Такая кислотно-основная двойственность химических свойств получила название «Амфотерность»

АМФОТЕРНОСТЬ
способность соединений проявлять либо кислотные либо основные свойства, в зависимости от того с чем они реагируют.

Амфотерный характер носят оксиды и гидроксиды большинства переходных элементов и многих элементов побочных подгрупп .

АМФОТЕРНЫЕ СОЕДИНЕНИЯ
К амфотерным соединениям относят оксиды и гидроксиды некоторых металлов
(в них металл чаще всего имеет степень окисления +3 , чуть реже +2 ).

АМФОТЕРНЫЕ ОКСИДЫ
Из оксидов двойственными свойствами обладают: оксид бериллия BeO , оксид цинка ZnO , оксид алюминия Al 2 O 3 , оксид олова( IV) SnO 2 , оксиды свинца PbO , PbO2 , оксид железа(III) Fe 2 O 3 , оксид хрома (III) Cr2O3 и др.

ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
При реакции с соляной кислотой оксида цинка образуются соль хлорид цинка и вода:
ZnO+2HCl=ZnCl 2 +H 2 O
Амфотерный оксид цинка в реакции со щелочью гидроксидом калия образовал соль цинкат калия и воду.
ZnO+2KOH=K 2 ZnO 2 +H 2 O
цинкат калия

АМФОТЕРНЫЕ ГИДРОКСИДЫ
Be(OH) 2
- гидроксид бериллия
Al(OH) 3
- гидроксид алюминия
Zn(OH) 2
- гидроксид цинка
Fe(OH) 3
- гидроксид железа( III)

ФИЗИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
Амфотерные гидроксиды – это нерастворимые в воде твердые вещества, как правило, белого цвета

ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
При реакции гидроксида цинка с соляной кислотой образуются соль хлорид цинка и вода :
Zn(OH)2+2HCl=ZnCl2+2H2O
Амфотерный гидроксид цинка в реакции со щелочью гидроксидом калия образовал соль цинкат калия и воду .
Zn(OH) 2 +2KOH=K 2 ZnO 2 +2H 2 O

ДОМАШНЕЕ ЗАДАНИЕ:
Прочитайте параграф 43 и выполните задания ниже в презентации.
Закончите уравнения реакций:
Cr(OH) 3 + 6HCl = ?
Cr(OH) 3 + NaOH = ?
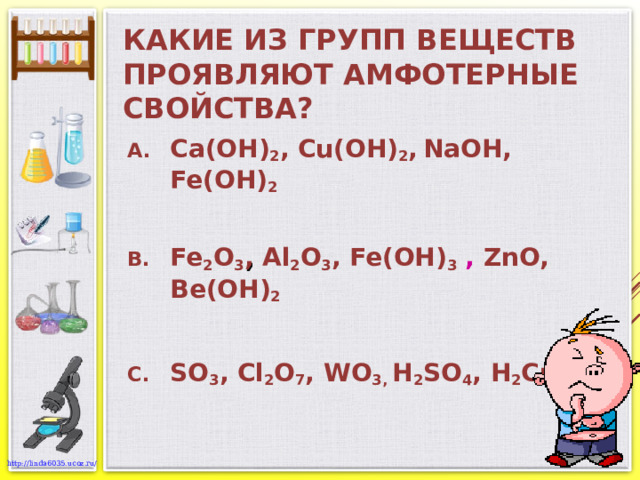
КАКИЕ ИЗ ГРУПП ВЕЩЕСТВ ПРОЯВЛЯЮТ АМФОТЕРНЫЕ СВОЙСТВА?
- Ca (ОН) 2 , Cu (ОН) 2 , Na ОН, Fe ( O Н) 2
- Fe 2 O 3 , Al 2 O 3 , Fe ( O Н) 3 , ZnO, Be ( O Н) 2
- SO 3 , Cl 2 O 7 , WO 3 , Н 2 SO 4 , Н 2 CrO 4

ДОПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ: ZN(OH) 2 + 2NAOH В РЕЗУЛЬТАТЕ ОБРАЗУЮТСЯ
- Na 2 ZnO 2 + 2H 2 O
- Zn(OH) 2 + Na 2 O
- ZnSO 4 + 2 NaCl
- Реакция не идет






























