
ЖЕЛЕЗО
Урок химии в 9 классе

Очень древний я металл, Счёт столетьям потерял! Я давно в названии века, В организме человека. Называют мной характер, Из меня почти весь трактор. Очень в яблоке полезно, И зовут меня

Характеристика химического элемента - железо.

План работы по теме урока:
1 . Положение Fe в Периодической системе
2. Строение атома
3. Физические свойства
4. Химические свойства
5. Качественные реакции
6. Биологическое значение

Цель урока:
Рассмотреть :
- Строение железа, как элемента побочной группы
Изучить:
- Свойства простого вещества:
физические и химические
- Качественные реакции на ионы
- Биологическое значение
Рассмотреть строение железа, как элемента побочной группы, изучить свойства простого вещества железа, нахождение в природе, применение и его биологическую роль.


1. Положение железа в ПСХЭ
2. Строение атома
1) Порядковый номер
2) Ar
3) Заряд ядра
4) число протонов, нейтронов, электронов
5) Строение электронной
Оболочки
6) Степень окисления

Строение атома железа

3.Физические свойства железа
Выпишите, пользуясь страницей 116, физические свойства железа.
Выпишите, пользуясь страницей 116, физические свойства железа.

Физические свойства железа
Проверим по образцу
1. Серебристо-серый металл,
2. ковкий,
3. пластичный,
4. плотность 7,87г/см 3 ;
5. tпл.=1539°С;
6. tкип.=2740°С;
7. хорошо проводит тепло и электричество,
8. обладает магнитными свойствами
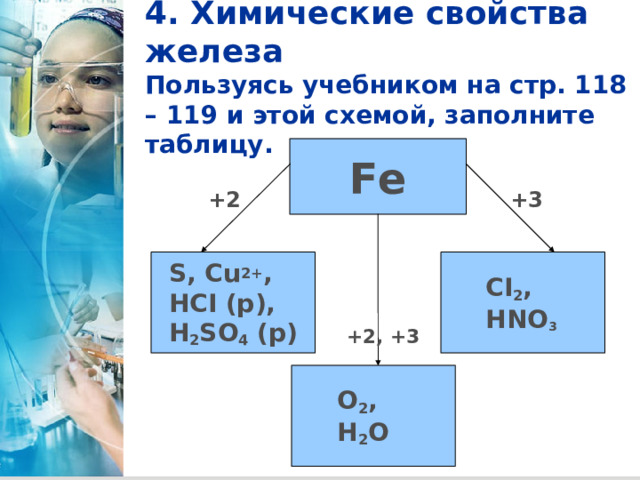
4. Химические свойства железа Пользуясь учебником на стр. 118 – 119 и этой схемой, заполните таблицу.
Fe
+2
+3
S, Cu 2+ ,
HCI (р) ,
H 2 SO 4 (р)
CI 2 ,
HNO 3
+2, +3
O 2 ,
H 2 O

Химические свойства железа
Проверим по образцу
Fe (+2)
Простые вещества
Fe (+3)
Сера
Fe + S → FeS
Кислород
-
3Fe + 2 О 2 → Fe 3 O 4 (FeO·Fe 2 O 3 )
Хлор
-
2Fe +3CL 2 → 2FeCL 3

Химические свойства железа
Проверьте по образцу
Fe (+2)
Сложные вещества
Fe (+3)
Кислота
Fe + 2HC l → FeC l 2 + H 2
Fe + H 2 SO 4 → Fe SO 4 + H 2
Вода
3Fe + 4H 2 O → Fe 3 O 4 (FeO·Fe 2 O 3 ) + 4H 2
Азотная
кислота
Ионы Cu
(+2)
-
Fe + CuSO 4 → FeSO 4 + Cu
Fе + 6HNOз (конц.) → Fе(NOз)з + 3NО 2 + 3Н 2 О
![5.Качественные реакции Демонстрационный опыт Качественная реакция на ион Fe 2+ 1. Реактив красная кровяная соль K 3 [ Fe ( CN ) 6 ] + FeSO 4 2. Реактив роданид калия К NCS + FeSO 4 Качественная реакция на ион Fe 3+ 1. Реактив красная кровяная соль K 3 [ Fe ( CN ) 6 ] + FeCl 3 2. Реактив роданид калия К NCS + FeCl 3](https://fsd.multiurok.ru/html/2022/11/23/s_637dd2d2452e5/img13.jpg)
5.Качественные реакции Демонстрационный опыт
Качественная реакция на ион Fe 2+
1. Реактив красная кровяная соль K 3 [ Fe ( CN ) 6 ] + FeSO 4
2. Реактив роданид калия
К NCS + FeSO 4
Качественная реакция на ион Fe 3+
1. Реактив красная кровяная соль K 3 [ Fe ( CN ) 6 ] + FeCl 3
2. Реактив роданид калия
К NCS + FeCl 3

Качественные реакции Демонстрационный опыт
Качественная реакция на ион Fe 2+
FeSO 4 + NaOH
Качественная реакция на ион Fe 3+
FeCl 3 + NaOH

6. Биологическое значение железа
Ионы железа входят в состав гемоглобина, который содержится в эритроцитах крови.
Источники железа:
Зеленные овощи, яичный желток,
Печень, горошек зеленый,
томаты сырые, капуста,
Чеснок, яблоки, груши,
земляника, сухофрукты.

6. Биологическое значение железа
Тест “Порядок ли у вас с железом”.
На вопросы отвечайте либо “да”, либо “нет”.
1. Часто ли вы чувствуете усталость и подавленность?
2. Произошли ли у вас в последнее время изменения кожи, волос и ногтей?
3. Теряли ли вы в последнее время много крови?
4. Занимаетесь ли вы профессиональным спортом?
5. Вы редко или совсем не едите мясо?
6. Выпиваете ли вы более трех чашек чая или кофе в день?
7. Вы едите мало овощей?
Если на большинство вопросов вы ответили “нет”, то ваш организм в достаточной степени обеспечен железом.

Применим знания
«Верите ли Вы, что ...»
Да Нет
1. Железо - это металл побочной подгруппы.
2. Железо хрупкий металл.
3. На внешнем энергетическом уровне атома железа находятся 6 электронов.
4. Для железа характерно постоянная степень окисления в соединениях +3.
5. Железо не взаимодействует с простыми веществами.
6. Атомы железа являются восстановителями.
7. Железо входит в состав гемоглобина.
8. Железо не встречается в природе в свободном состоянии.
9. Железо обладает магнитными свойствами.
Рассмотреть строение железа, как элемента побочной группы, изучить свойства простого вещества железа, нахождение в природе, применение и его биологическую роль.

Оцените друг друга
Да, Нет, Нет, Нет, Нет, Да, Да, Нет, Да.
0 ошибок – оценка 5
1 ошибка – оценка 4
2- 4 ошибки – оценка 3
5 – 9 ошибок – оценка 2
Рассмотреть строение железа, как элемента побочной группы, изучить свойства простого вещества железа, нахождение в природе, применение и его биологическую роль.

Цель урока:
Рассмотреть :
- Строение железа, как элемента побочной группы
Изучить:
- Свойства простого вещества:
физические и химические
- Качественные реакции на ионы
- Биологическое значение
Рассмотреть строение железа, как элемента побочной группы, изучить свойства простого вещества железа, нахождение в природе, применение и его биологическую роль.

Домашняя работа
§ 17



















![5.Качественные реакции Демонстрационный опыт Качественная реакция на ион Fe 2+ 1. Реактив красная кровяная соль K 3 [ Fe ( CN ) 6 ] + FeSO 4 2. Реактив роданид калия К NCS + FeSO 4 Качественная реакция на ион Fe 3+ 1. Реактив красная кровяная соль K 3 [ Fe ( CN ) 6 ] + FeCl 3 2. Реактив роданид калия К NCS + FeCl 3](https://fsd.multiurok.ru/html/2022/11/23/s_637dd2d2452e5/img13.jpg)

















