
Выполнила: учитель химии Капранчикова О.И.
Железо,
его соединения
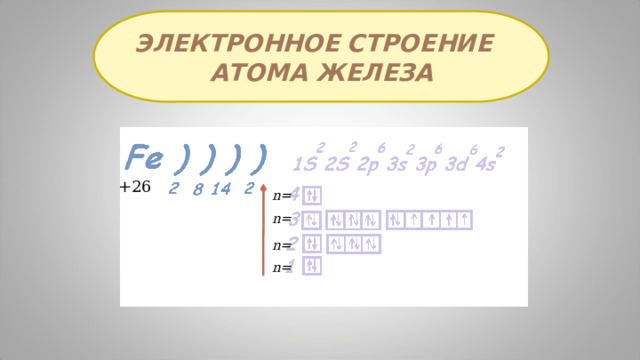
Электронное строение
атома железа
+26
n=
n=
n=
n=

Нахождение в природе
В земной коре на долю железа приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов).
Известно большое число руд и минералов, содержащих железо.
Оно бывает в виде различных соединений: оксидов, гидроксидов и солей.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.

Минералы
Магнитный железняк, или магнетит
Fe 3 O 4
Красный железняк, или гематит
Fe 2 O 3
Бурый железняк, или лимонит
2Fe 2 O 3 · 3H 2 O
Железный колчедан, или пирит
Второе место по распространённости
FeS 2
среди металлов.
Гидрокарбонат железа
Fe(HCO 3 ) 2

Метеорит массой 60 т
Метеорит массой 30 т

Получение:
t
2Fe 2 O 3 + 3C = 4Fe + 3CO 2
Восстановление углём
t
Восстановление оксидом
углерода (II)
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
t
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
Восстановление водородом
t
Fe 2 O 3 + 2Al = 2Fe + Al 2 O 3
Восстановление алюминием

Серебристо-серый
Тяжелый ( плотность=7,8 г\см 3 )
ковкий;
обладает
магнитными свойствами
Физические свойства железа
Тугоплавкий
(Тпл.=1535 0 C)

Химические свойства
Реакции с простыми веществами
Железо сгорает в чистом кислороде при нагревании:3Fe +2O 2 =Fe 3 O 4
Реагирует с порошком серы при нагревании:Fe +S = FeS
Реагирует с галогенами при нагревании:2Fe + 3CL 2 =2FeCL 3

Химические свойства
Реакции со сложными веществами
С кислотами:
А) с соляной кислотой
2HCL + Fe = FeCL 2 + H 2
Б) с раствором серной кислоты
H 2 SO 4 + Fe = FeSO 4 + H 2
С солями:
Fe + CuSO 4 = Cu + FeSO 4
С водой(при высокой температуре):
3Fe + 4H 2 O=Fe 3 O 4 +4H 2
(железная окалина)

СОЕДИНЕНИЯ
ЖЕЛЕЗА
гидроксиды:
оксиды:
FeO, Fe 2 O 3
Fe(OH) 2
Fe 3 O 4
Fe(OH) 3
Соли (+2) (+3)- растворимые и нерастворимые:
Fe(NO 3 ) 2 , FeCL 3 , Fe 2 (SO 4 ) 3 , FeS…..

FeO и Fe(OH) 2 обладают основными свойствами
FeO + 2H + = Fe 2+ + H 2 O
Fe(OH) 2 + 2H + = Fe 2+ + 2H 2 O
t
Fe 2 O 3 + CO = 2FeO + CO 2
4Fe(OH) 2 + 2H 2 O + O 2 = 4Fe(OH) 3

Fe 2 O 3 и Fe(OH) 3 проявляют слабовыраженные
амфотерные свойства
Реакции с кислотами
t
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
Fe 2 O 3 + 6H + = 2Fe 3+ + 3H 2 O
Fe(OH) 3 + 3H + = Fe 3+ + 3H 2 O
Реакции с основаниями
t
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O
t
Fe(OH) 3 + NaOH = NaFeO 2 + 2H 2 O
NaFeO 2 — феррит натрия
![Распознавание соединений Распознавание соединений железа (II) железа (III) K 4 [Fe(CN) 6 ] K 3 [Fe(CN) 6 ] Красная кровяная соль Жёлтая кровяная соль K 4 [Fe(CN) 6 K 3 [Fe(CN) 6 ] FeCl 2 + K 3 [Fe(CN) 6 ] = FeCl 3 + K 3 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ]↓ + 2KCl KFe[Fe(CN) 6 ]↓ + 2KCl](https://fsd.multiurok.ru/html/2023/09/19/s_6509fb515dc78/img12.jpg)
Распознавание соединений
Распознавание соединений
железа (II)
железа (III)
K 4 [Fe(CN) 6 ]
K 3 [Fe(CN) 6 ]
Красная кровяная соль
Жёлтая кровяная соль
K 4 [Fe(CN) 6
K 3 [Fe(CN) 6 ]
FeCl 2 + K 3 [Fe(CN) 6 ] =
FeCl 3 + K 3 [Fe(CN) 6 ] =
KFe[Fe(CN) 6 ]↓ + 2KCl
KFe[Fe(CN) 6 ]↓ + 2KCl

Распознавание соединений
железа (III)
NH 4 SCN
KSCN
Роданид калия
Роданид аммония
KSCN
Fe 3+ + SCN - ↔ FeSCN 2+

Fe → FeCl 3 → Fe(OH) 3 → Fe 2 O 3
Рефлексия
2
1
3
1 )
Fe → FeCl 2 → Fe(OH) 2 → FeO
2)

Применение железа и его соединений
FeSO 4 · 7H 2 O- железный купорос

Железо содержится:

РефлексияДД
Д/З п. 48,49. Индивидуальные сообщения:
применение железа


















![Распознавание соединений Распознавание соединений железа (II) железа (III) K 4 [Fe(CN) 6 ] K 3 [Fe(CN) 6 ] Красная кровяная соль Жёлтая кровяная соль K 4 [Fe(CN) 6 K 3 [Fe(CN) 6 ] FeCl 2 + K 3 [Fe(CN) 6 ] = FeCl 3 + K 3 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ]↓ + 2KCl KFe[Fe(CN) 6 ]↓ + 2KCl](https://fsd.multiurok.ru/html/2023/09/19/s_6509fb515dc78/img12.jpg)















