Данная презентация является приложением к технологической карте урока.
Разработка урока соответствует современным фгосам. Содержит технологии проблемного изучения, компетентно-ориентированные задания, интерактивные технологии, здоровья сбережения.
Цель: формирование знаний и умений:
Образовательная: рассматривать положение химического элемента железа в периодической системе химических элементов Д. И Менделеева, строение атома, биологическую роль железа, понимать химические и физические свойства простого вещества - железа.
Развивающая: привитие навыков составления уравнений химических реакций, логически мыслить, совершенствования умения доказывать, сравнивать.
Воспитательная: повышение интереса к предмету, воспитание внимательности, аккуратности при написании уравнений реакций, гордости за свою Родину, как самую богатую природными ресурсами страну, воспитанию экологической культуры.
Просмотр содержимого документа
«Презентация по химии в 9 классе. Железо.»

Лапина Оксана Викторовна.
Лапина Оксана Викторовна

- 1. Визитная. Железо как химический элемент. (Строение атома, степени окисления)
- 2. Историческая. История открытия железа
- 3. Физическая и Химическая. Железо как простое вещество (аллотропия, физические и химические свойства,
- 4. Промышленная (получение в промышленности).
- 5. Биологическая. Значение железа



- http://fcior.edu.ru/card/26775/zhelezo-istoriya-otkrytiya-svoystva-primenenie.html

![Допишите уравнения А) С простыми веществами (окислителями) 3Fe+2O2 = Fe3O4(FeO•Fe2O3), Fe+CI2 = , 4Fe+N2 = 2Fe2N Fe + S = , 3Fe + C = Fe3C Б) С водой 3Fe+4H2O = 4H2↑+Fe3O4; 4Fe+ 4H2O+ 3O2 = 4Fe(OH)3рж. В) С кислотами Холодные концентрированные H 2 SO 4 и HNO 3 пассивируют железо Fe + 2HCl = , Fe + H 2 SO 4 разб . = Fe + H2SO4разб. = FeSO4 + H2↑, t0 2Fe + 6H2SO4конц. = Fe2(SO4)3 = 3SO2↑ + 6H2O Fe + 6HNO3конц. = Fe(NO3)3 + 3NO2↑ + 3H2O Fe + 4HNO3разб. = Fe(NO3)3 + NO↑ + 2H2O 10Fe + 36HNO3очень разб. =10 Fe(NO3)3 + 3N2↑ + 18H2O Г) Со сложными окислителями 2Fe+K2Cr2O7+7H2SO4 = Fe2(SO4)3+ Cr2(SO4)3+ K2SO4+ 7H2О Д) Со щелочами Fe + 2 NaOH + 2H2O= Na2[Fe(OH)4] + H2↑ 4Fe + 20 NaOH + 6 H2O + 3O2 = 4Na5[Fe(OH)8] Е) С солями (см. электрохимический ряд напряжений металлов) Fe + CuSO4 =](https://fsd.multiurok.ru/html/2019/11/10/s_5dc7799c951bb/img6.jpg)
Допишите уравнения
А) С простыми веществами (окислителями)
3Fe+2O2 = Fe3O4(FeO•Fe2O3), Fe+CI2 = , 4Fe+N2 = 2Fe2N
Fe + S = , 3Fe + C = Fe3C
Б) С водой
3Fe+4H2O = 4H2↑+Fe3O4; 4Fe+ 4H2O+ 3O2 = 4Fe(OH)3рж.
В) С кислотами
Холодные концентрированные
H 2 SO 4 и HNO 3
пассивируют железо
Fe + 2HCl = ,
Fe + H 2 SO 4 разб . =
Fe + H2SO4разб. = FeSO4 + H2↑,
t0
2Fe + 6H2SO4конц. = Fe2(SO4)3 = 3SO2↑ + 6H2O
Fe + 6HNO3конц. = Fe(NO3)3 + 3NO2↑ + 3H2O
Fe + 4HNO3разб. = Fe(NO3)3 + NO↑ + 2H2O
10Fe + 36HNO3очень разб. =10 Fe(NO3)3 + 3N2↑ + 18H2O
Г) Со сложными окислителями
2Fe+K2Cr2O7+7H2SO4 = Fe2(SO4)3+ Cr2(SO4)3+ K2SO4+ 7H2О
Д) Со щелочами
Fe + 2 NaOH + 2H2O= Na2[Fe(OH)4] + H2↑
4Fe + 20 NaOH + 6 H2O + 3O2 = 4Na5[Fe(OH)8]
Е) С солями (см. электрохимический ряд напряжений металлов)
Fe + CuSO4 =

Способы получения
1. Прямое восстановление 5. Мартеновский
2. Карбонильный 6. Конверторный
3. Кричный 7.Электротермический
4. Доменный 8. Термитный
Уравнения реакций
- 3Fe2O3 + CO =
- 2. Fe3O4+ CO
- FeO+ CO =
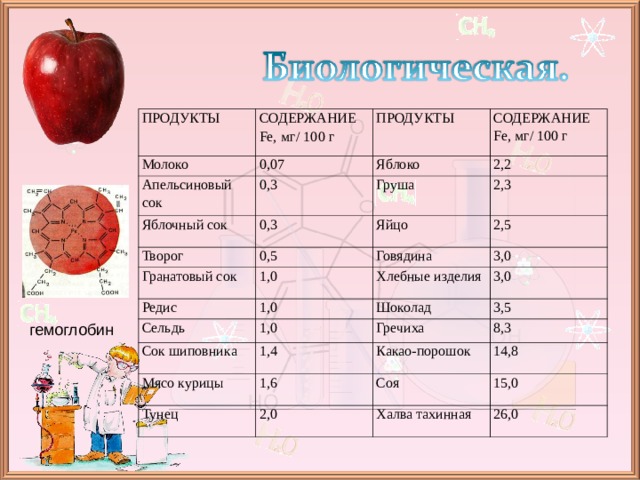
ПРОДУКТЫ
СОДЕРЖАНИЕ F е, мг/ 100 г
Молоко
0,07
ПРОДУКТЫ
Апельсиновый сок
Яблочный сок
СОДЕРЖАНИЕ F е, мг/ 100 г
Яблоко
0,3
0,3
2,2
Творог
Груша
2,3
Яйцо
0,5
Гранатовый сок
2,5
1,0
Говядина
Редис
Сельдь
3,0
Хлебные изделия
1,0
1,0
3,0
Шоколад
Сок шиповника
3,5
1,4
Мясо курицы
Гречиха
8,3
1,6
Тунец
Какао-порошок
2,0
Соя
14,8
15,0
Халва тахинная
26,0
гемоглобин

- https://present5.com/presentation/3/14337672_186600367.pdf-img/14337672_186600367.pdf-7.jpg
- https://poznanie21.ru/wp-content/uploads/2019/06/884328_900.jpg
- https://ds02.infourok.ru/uploads/ex/0f96/00025985-afaee64b/img8.jpg
- https://www.almrsal.com/wp-content/uploads/2014/05/apple.j pg













![Допишите уравнения А) С простыми веществами (окислителями) 3Fe+2O2 = Fe3O4(FeO•Fe2O3), Fe+CI2 = , 4Fe+N2 = 2Fe2N Fe + S = , 3Fe + C = Fe3C Б) С водой 3Fe+4H2O = 4H2↑+Fe3O4; 4Fe+ 4H2O+ 3O2 = 4Fe(OH)3рж. В) С кислотами Холодные концентрированные H 2 SO 4 и HNO 3 пассивируют железо Fe + 2HCl = , Fe + H 2 SO 4 разб . = Fe + H2SO4разб. = FeSO4 + H2↑, t0 2Fe + 6H2SO4конц. = Fe2(SO4)3 = 3SO2↑ + 6H2O Fe + 6HNO3конц. = Fe(NO3)3 + 3NO2↑ + 3H2O Fe + 4HNO3разб. = Fe(NO3)3 + NO↑ + 2H2O 10Fe + 36HNO3очень разб. =10 Fe(NO3)3 + 3N2↑ + 18H2O Г) Со сложными окислителями 2Fe+K2Cr2O7+7H2SO4 = Fe2(SO4)3+ Cr2(SO4)3+ K2SO4+ 7H2О Д) Со щелочами Fe + 2 NaOH + 2H2O= Na2[Fe(OH)4] + H2↑ 4Fe + 20 NaOH + 6 H2O + 3O2 = 4Na5[Fe(OH)8] Е) С солями (см. электрохимический ряд напряжений металлов) Fe + CuSO4 =](https://fsd.multiurok.ru/html/2019/11/10/s_5dc7799c951bb/img6.jpg)














