Предельные
одноатомные спирты
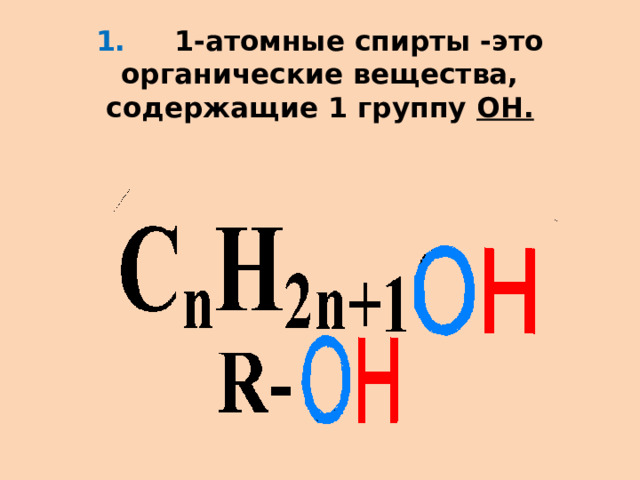
1. 1-атомные спирты -это органические вещества, содержащие 1 группу ОН.
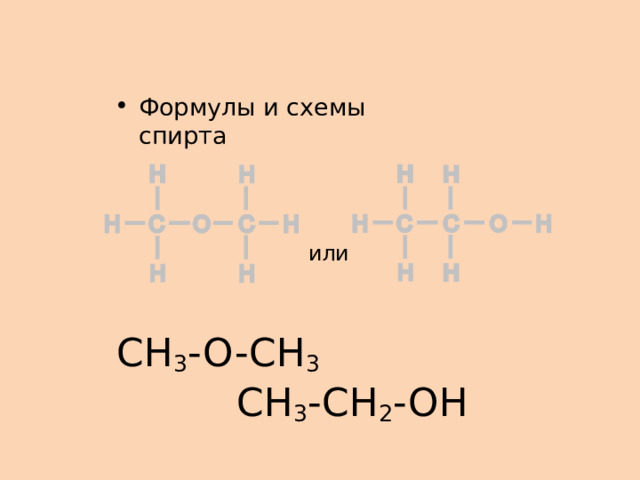
или
CH 3 -O-CH 3 CH 3 -CH 2 -OH

- XV в. – впервые Парацельс применил к этанолу название алкоголь.
- 1833 г. – Берцелиус определил молекулярную формулу этилового спирта – C 2 H 6 O
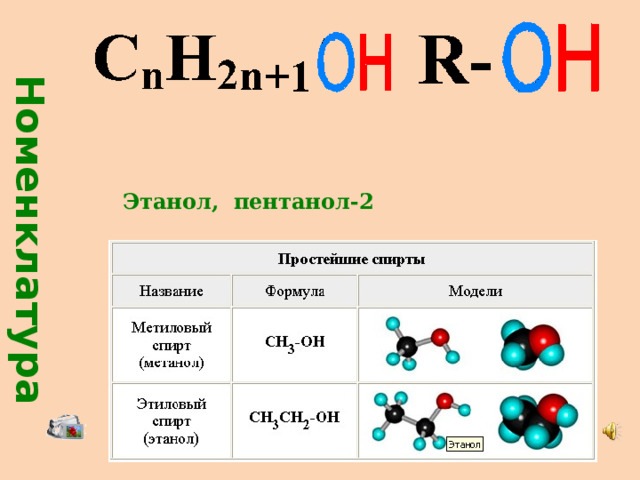
Номенклатура
Этанол, пентанол-2
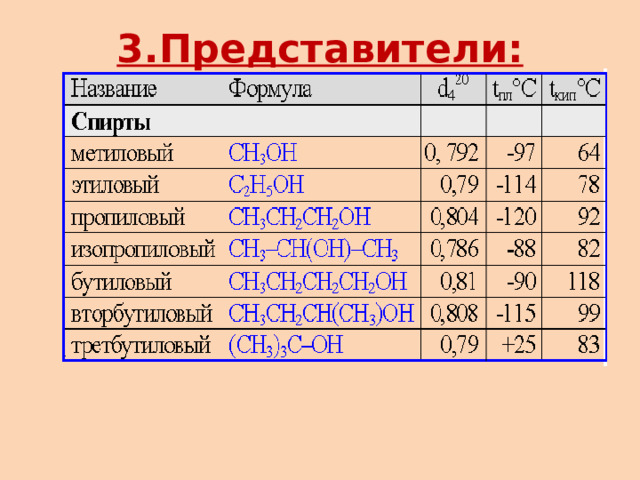
3.Представители:
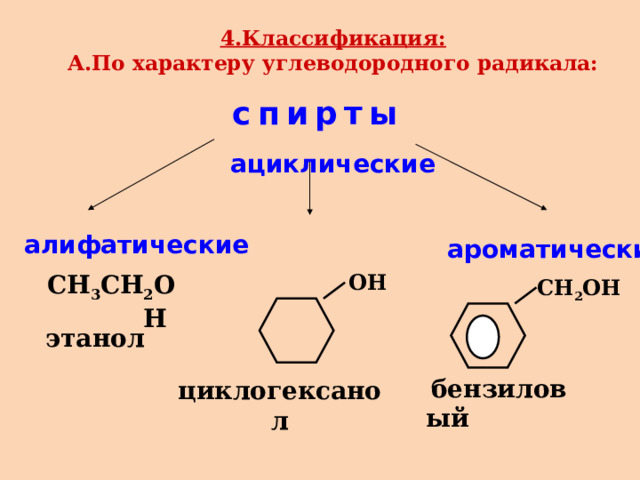
4.Классификация: А.По характеру углеводородного радикала:
спирты
ациклические
алифатические
ароматические
СН 3 СН 2 ОН
ОН
СН 2 ОН
этанол
бензиловый спирт
циклогексанол
7
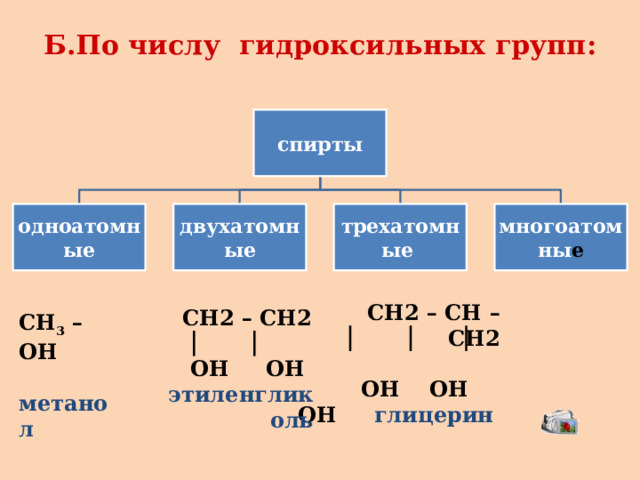
Б.По числу гидроксильных групп:
спирты
одноатомные
двухатомные
многоатомны е
трехатомные
СН2 – СН – СН2
ОН ОН ОН глицерин
СН2 – СН2
ОН ОН
этиленгликоль
СН 3 – ОН
метанол
8

5. изомерия спиртов:
1. Углеродной цепи.
2. Положения
функциональной группы.
3.Межклассовая с эфирами.
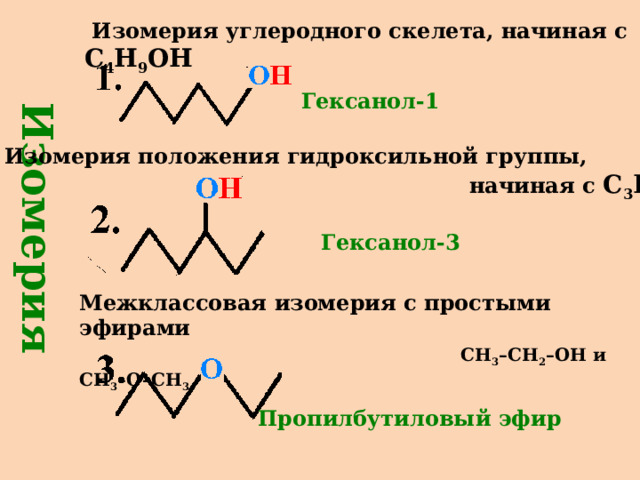
Изомерия
Изомерия углеродного скелета, начиная с C 4 H 9 OH
Гексанол-1
Изомерия положения гидроксильной группы,
начиная с С 3 Н 7 ОН
Гексанол-3
Межклассовая изомерия с простыми эфирами
СН 3 –СН 2 –ОН и СН 3 –О–СН 3
Пропилбутиловый эфир
8

6.Физические свойства
Агрегатное состояние :
С 1 -С 11 - жидкости
С 12 –С 20 - твердые вещества
Запах
С 1 -С 3 - «спиртовой» запах
С 4 -С 6 - «сивушный» запах
С 11 - запаха нет
Растворимость в воде,
высокая
легче воды
Б/цвета
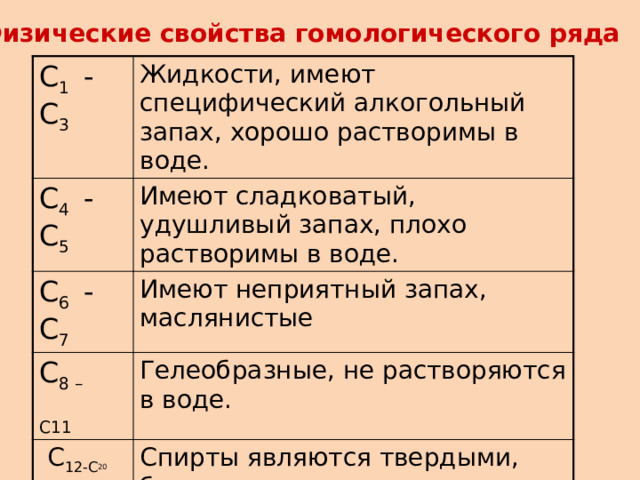
6.Физические свойства гомологического ряда
C 1 - C 3
Жидкости, имеют специфический алкогольный запах, хорошо растворимы в воде.
C 4 - C 5
Имеют сладковатый, удушливый запах, плохо растворимы в воде.
C 6 - C 7
Имеют неприятный запах, маслянистые
C 8 –
С11
Гелеобразные, не растворяются в воде.
C 12-С 20
Спирты являются твердыми, без запаха, нерастворимы

6.Физические свойства .
- Температура кипения спиртов выше температуры кипения соответствующих углеводородов.
- С увеличением относительной молекулярной массы спиртов повышаются их температуры кипения, уменьшается растворимость в воде.

7.Химические свойства:
1.Горение спиртов: C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O
2. Взаимодействие со щелочными металлами:
2C 2 H 5 OH + 2Na → 2C 2 H 5 ONa + H 2 ↑
3. Окисление спиртов оксидом металла:
C 2 H 5 OH + CuO → CH 3 COH + Cu + + H 2 O (реакция идет при нагревании)
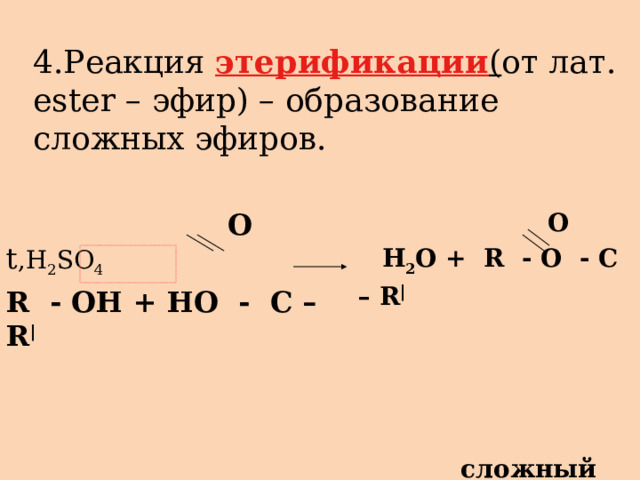
4.Реакция этерификации ( от лат. ester – эфир) – образование сложных эфиров.
O t ,H 2 SO 4
О
R - OH + HO - C – R |
H 2 O + R - O - C – R |
сложный эфир
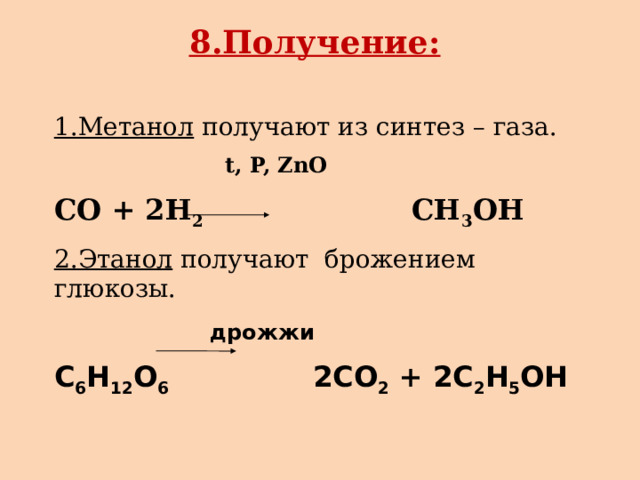
8.Получение:
1.Метанол получают из синтез – газа.
t, P, ZnO
CO + 2H 2 CH 3 OH
2.Этанол получают брожением глюкозы.
дрожжи
C 6 H 12 O 6 2CO 2 + 2C 2 H 5 OH
Применение спиртов

9.Применение
CH 3 OH
Производство формальдегида, медикаментов.
C 2 H 5 OH
Получение уксусной кислоты, медикаментов, красителей, растворителей, горючего для двигателей и т.д.
C 5 H 11 OH
В парфюмерии ; как реагент для определения жирности молочных продуктов.
C 16 – C 20
Антикоррозийные смазки
C 18 – C 20
Медицинские препараты

Вредное воздействие этанола
- Изменения структуры мозга, вызванные многолетней алкогольной интоксикацией, почти необратимы, и даже после длительного воздержания от употребления спиртных напитков они сохраняются.
- Если же человек не может остановиться, то органические и, следовательно, психические отклонения от нормы идут по нарастающей .

Вредное воздействие этанола
- Алкоголь крайне неблагоприятно влияет на сосуды головного мозга. В начале опьянения они расширяются, кровоток в них замедляется, что приводит к застойным явлениям в головном мозге.
- Затем, когда в крови помимо алкоголя начинают накапливаться вредные продукты его неполного распада, наступает резкий спазм, сужение сосудов, развиваются такие опасные осложнения, как мозговые инсульты, приводящие к тяжелой инвалидности и даже смерти.
Возникает ситуация, когда структуры головного мозга уже не могут функционировать без алкоголя,
а печень не способна его перерабатывать
Этиловый спирт-наркотик , который вследствие высокой растворимости быстро всасывается в кровь.

Метиловый спирт - бесцветная жидкость, кипящая при температуре 65 ˚ С.
5 –10 мл метанола вызывают слепоту и сильное отравление организма, а 30 мл могут привести к смертельному исходу .
СН 3 ОН
МЕТАНОЛ

Составьте структурные формулы:
- А. 2,3-диметил гептанол -1
- Б.2-метил,3-этил,4-бутил октанол -1
- В. 3,3-диметил,4,4-диэтил нонанол -1
- Г. 3-метил, 6-этил деканол -2
- Д. 4,4,5,6-тетраметил нонанол -2
- Е. пентанол-2
- Ж. гептанол-3.
- З. бутанол-1.
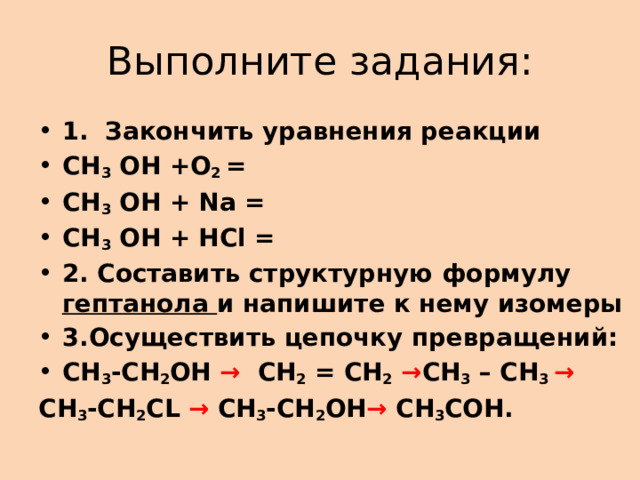
Выполните задания:
- 1. Закончить уравнения реакции
- СН 3 ОН +О 2 =
- СН 3 ОН + Nа =
- СН 3 ОН + НCl =
- 2. Составить структурную формулу гептанола и напишите к нему изомеры
- 3.Осуществить цепочку превращений:
- СН 3 -СН 2 ОН → СН 2 = СН 2 → СН 3 – СН 3 →
СН 3 -СН 2 CL → СН 3 -СН 2 ОН → CH 3 COH.

Решите задачи.
- 1.У какого из спиртов нонанол или деканол относительная молекулярная масса наибольшая?
- 2. Определите массовую долю каждого элемент и плотность по водороду и воздуху у этилового , пентилового и гексилового спиртов .
- 3. Относительная плотность паров органического соединения по водороду равна 55. Массовая доля углерода в этом веществе равна 65,45%,массовая доля водорода равна 5,45%, массовая доля кислорода равна 29,1%. Выведите молекулярную формулу данного соединения.



















































