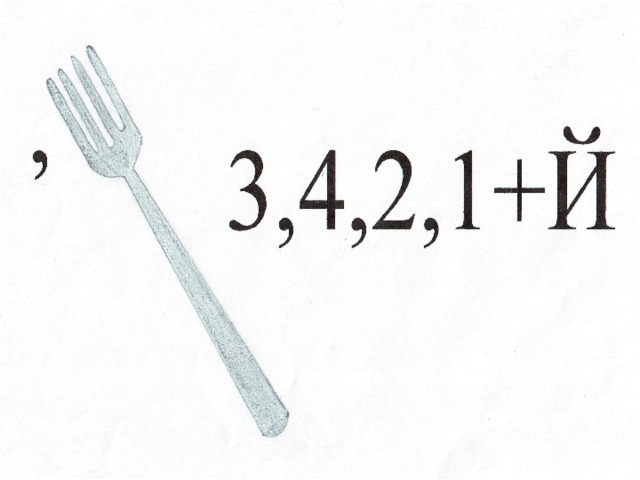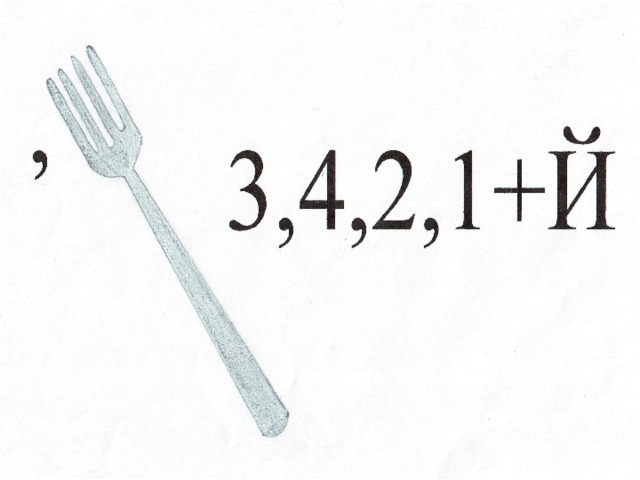


Напишите уравнения реакций между: а) калием и хлором,
б) натрием и йодом, в) литием и водой.
Рассмотрите реакции как окислительно-восстановительные
Na 0 + I 2 0 = Na + I ─
K 0 + Cl 2 0 = K + Cl ─
2
2
2
2
Na 0 ─ 1e → Na + 1 2
I 2 0 + 2e → 2I ─ 2 1
K 0 ─ 1e → K + 1 2
Cl 2 0 + 2e → 2CL ─ 2 1
Na – восстановитель, пр. окисления
K – восстановитель, пр. окисления
I 2 – окислитель, пр. восстановления
Cl 2 – окислитель, пр. восстановления
2
2
Li 0 + 2Н + 2 О = Li + ОН + Н 2 0
Li 0 ─ 1e → Li + 1 2
2Н + + 2e → Н 2 0 2 1
Li 0 – восстановитель, пр. окисления
2Н + – окислитель, пр. восстановления

Соединения щелочных металлов

Составьте формулу оксида натрия:
Na 2 O
основный
Определите характер оксида:
Оксид натрия представляет собой бесцветные кристаллы. Хранить Na 2 O лучше всего в безводном бензоле.
Температура плавления – 1132 °C
Температура кипения – 1950 °С
Плотность – 2,27г/см 3

Получение:
1. Взаимодействие металлического натрия с кислородом
Чистый оксид натрия получить непосредственным окислением натрия
нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия :
6Na + 2O 2 = 2Na 2 O + Na 2 O 2
2. Прокаливание пероксида натрия с избытком натрия:
2Na + Na 2 O 2 = 2Na 2 O

Химические свойства.
Перечислите свойства основных оксидов.
Основные оксиды взаимодействуют с водой (если данному оксиду
соответствует растворимое или малораствоимое основание), с кислотными
и амфотерными оксидами, с кислотами.
Составьте уравнения реакций оксида натрия с водой, оксидом фосфора(V),
Na 2 O + H 2 O = 2NaOH
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
3Na 2 O + P 2 O 5 = 2Na 3 PO 4

Составьте формулу гидроксида натрия:
NaOH
Твердое белое кристаллическое вещество, хорошо растворимое в
воде. Процесс растворения сопровождается выделением достаточного
количества теплоты.

Химические свойства
Перечислите свойства характерные
для растворимых оснований.
Растворы щелочей изменяют окраску
индикаторов. В присутствии щелочи лакмус окрашивается в синий цвет, метилоранж – в жёлтый, фенолфталеин – в малиновый.
индикатор
Реакция среды
щелочная
нейтральная
кислотная
лакмус
синий
красный
фиолетовый
метилоранж
красный
оранжевый
желтый
фенолфталеин
бесцветный
бесцветный
малиновый
Лабораторный опыт:

Лабораторные опыты «Свойства гидроксида натрия»
С правилами ТБ ознакомлен __________
Инструкция
- Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете?
- Добавьте в эту же пробирку раствор серной кислоты. Что наблюдаете? Запишите уравнение реакции.
- Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции.
Сделайте вывод о химических свойствах гидроксидов щелочных металлов.
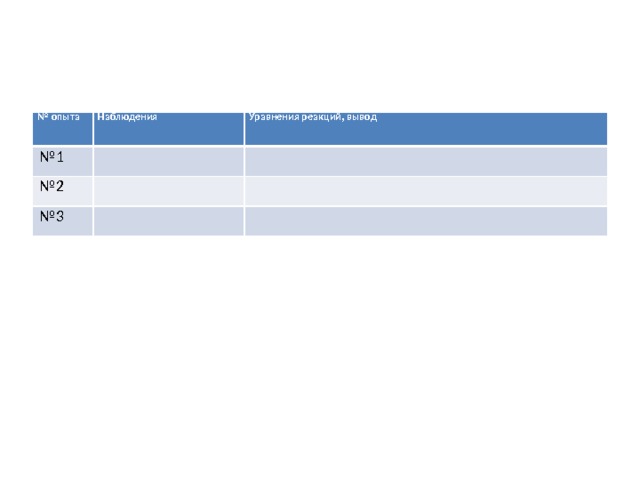
№ опыта
Наблюдения
№ 1
Уравнения реакций, вывод
№ 2
№ 3

Применение соединений
щелочных металлов
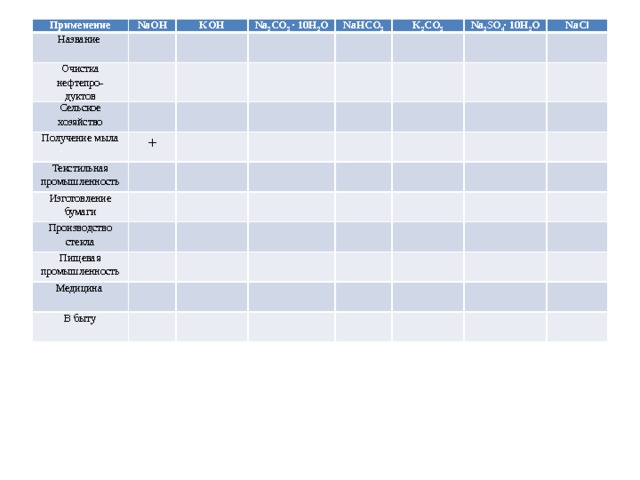
Применение
Название
NaOH
Очистка нефтепро-
KOH
Сельское хозяйство
дуктов
Na 2 CO 3 ∙ 10H 2 O
NaHCO 3
Получение мыла
K 2 CO 3
+
Текстильная промышленность
Na 2 SO 4 ∙ 10H 2 O
Изготовление бумаги
Производство стекла
NaCl
Пищевая промышленность
Медицина
В быту

Применение NaOH
Едкий натр применяется в огромном множестве отраслей промышленности
и для бытовых нужд:
Каустик применяется в целлюлозно-бумажной промышленности.
В производстве бумаги, картона, искусственных волокон, древесно-
волоконных плит

Для омыления жиров при производстве мыла, шампуня и других
моющих средств

В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется.
О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 г. н. э. Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад.

В химических отраслях промышленности — для нейтрализации
кислот и кислотных оксидов, как реагент или катализатор в
химических реакциях, в нефтепереработке —для производства масел, очистке нефти.

В качестве агента для растворения засоров канализационных
труб в виде сухих гранул или в составе гелей. Гидроксид натрия
дезагрегирует засор и способствует лёгкому продвижению его
далее по трубе.

КОН
Гидроксид калия (едкий кали)
Применяют при производстве жидкого мыла

Соли.
Твердые кристаллические вещества ионного строения.
Большинство солей натрия и калия растворимы в воде.
Наибольшее значение имеют карбонаты, сульфаты и хлориды.
карбонаты
гидрокарбонаты
сульфаты
хлориды

Карбонат натрия.
Карбонаты
Na 2 CO 3
Na 2 CO 3 образует кристаллогидрат Na 2 CO 3 ·10Н 2 О , известный под
названием кристаллическая сода. Это вещество применяют в
производстве
для устранения жесткости воды
бумаги,
мыла,
стекла,

гидрокарбонаты
NaНCO 3
Пищевая сода
Применяется:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов; товаров бытовой химии; наполнителей в огнетушителях, при производстве стекла.
- в легкой промышленности — в производстве искусственных кож,
кожевенном производстве (дубление и нейтрализация кож), текстильной
промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских
изделий, приготовлении напитков. Зарегистрирован в качестве пищевой
добавки E500
- в медицине раствор питьевой соды используется в качестве слабого
антисептика для полосканий, а также как традиционное
кислотонейтрализующее средство от изжоги и болей в желудке.

сульфаты
Na 2 SO 4
Сульфат натрия образует кристаллогидрат
Na 2 SO 4 · 10Н 2 О , известный под названием
глауберова соль
Применяется для производства соды, стекла, как слабительное средство.


NaCl
хлориды
Хлорид натрия – поваренная соль
Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты»
Поваренную соль применяют при производство химических веществ: соляной кислоты, гидроксида натрия
хлора, соды, для консервирования,
приправа к пище, производство мыла, в медицине

Биологическая роль ионов натрия и калия
Катион
Биологическая роль
Na +
Продукты богатые катионами
K +

Нормы потребления поваренной соли
№
Сайт
1
Википедия
Норма потребления
2
Медицинская энциклопедия
поваренной соли в сутки
10-15 г
3
10-15 г
Как просто
4
Гипермаркет знаний
10-15 г
5
До 8 г
FB.ru
2-6г

Домашнее задание
Параграф 14 упр2,5
Составить презентацию о применении соединений кальция и магния