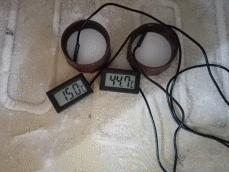Введение
Учась в школе я начал исследовать поведение воды при замерзании, вот такое было начало.
В этом году во многих регионах России стояли сильные морозы и в сети появилось много видео с интересным названием «Дубак челлендж». Красивая картинка получалась из-за того, что капельки кипятка на сильном морозе мгновенно превращались в льдинки. Любопытно то, что с холодной водой это явление не наблюдается. Хотя у нас стояли не столь сильные морозы всего-то -25, мне все-таки удалось наблюдать это явление. Я проделал такой опыт, т.е. выплёскивал над собой и кипяток, и воду комнатной температуры. Действительно, кипяток успевал замёрзнуть, а холодная вода - нет. Я поискал объяснения в сети, а там всё сводится к ещё большей загадке - парадоксу Мпембы. Суть его в том, что более горячая вода замерзает (кристаллизуется) раньше холодной.
Цель работы: Попытаться объяснить природу парадокса Мпембы.
Задачи: Провести эксперимент и изучить структуру воды.
Эффект Мпембы
С этим парадоксом люди знакомы с давних времён, однако не придавали ему значения. Явление при котором горячая вода замерзает быстрее холодной отмечал ещё Аристотель. Начало научного изучения этого явления было положено в 1963году. Пытливый юноша из Танзании Эрасто Мпемба, будучи студентом кулинарного техникума обратил внимание на то, что при приготовлении мороженого более горячая смесь замёрзла раньше более холодной . Он повторил эксперимент с водой и парадоксальный эффект повторился. Случилось так, что Мпембе посчастливилось встретиться с профессором Деннисом Осборном и изложить ему суть эксперимента. Осборн заинтересовался наблюдениями юноши, провёл ряд экспериментов, подтвердивших наличие эффекта, но причины установлены не были. Было выдвинуто много гипотез о причинах возникновения эффекта.
В 2012году Британским Королевским химическим обществом был объявлен конкурс гипотез, объясняющих эффект. Было выдвинуто более 20000 научных работ от учёных всего мира, но не одна статья не внесла ясности в это загадочное явление. Я не буду перечислять все версии, их можно увидеть, открыв в поисковике «Эффект Мпембы». Самое последнее объяснение предложили учёные из Китая и США.
Авторы опирались на поведение кластеров молекул воды объединённых водородными связями. Водородные связи намного слабее ковалентных, однако, сила их зависит от геометрии взаимного расположения молекул, между которыми эта связь образуется. По мере нагревания водородные связи ослабевают и, как показало моделирование, молекулы воды в кластерах меняют положение, занимая такие позиции, из которых им проще переходить к кристаллической структуре льда. В холодной воде всё происходит также, только энергии на разрыв водородных связей требуется больше – и замерзание, соответственно, должно проходить медленнее.
Чтобы как то понять эту гипотезу я решил обратиться к строению воды. Казалось бы, что может быть проще воды, но как оказывается самое простое бывает крайне сложным. Не смотря на то, что вода была известна человечеству от начала его существования, впервые в лабораторных условиях она была получена лордом Г. Кавендишем в 1781году при сгорании водорода.
В 1783году Лавуазье предложил истинный состав воды как сложного соединения кислорода и водорода.
В 1800году А. Карлейль и У. Никольсон электрическим током от вольтова столба разложили воду на кислород и водород.
1805год. Ж. Л. Гей-Люссак и А. Гумбольдт установили, что для образования воды необходимо 2 объёма водорода и 1 объём кислорода.
1842год. Ж. Б. Дюма установил весовое соотношение водорода и кислорода как 2:16.
1860год. С. Канницаро предложил точную химическую формулу воды как H2O.
К настоящему времени предложено более 100 структурных моделей воды.
Я не буду добросовестно переписывать научные статьи, тем более, что мне там ничего не понятно. Остановлюсь лишь на том, что, как мне кажется, относится к эффекту Мпембы.
Кластерная модель
Кластеры – группа молекул объединённых водородными связями, плавающие в объёме свободных молекул.
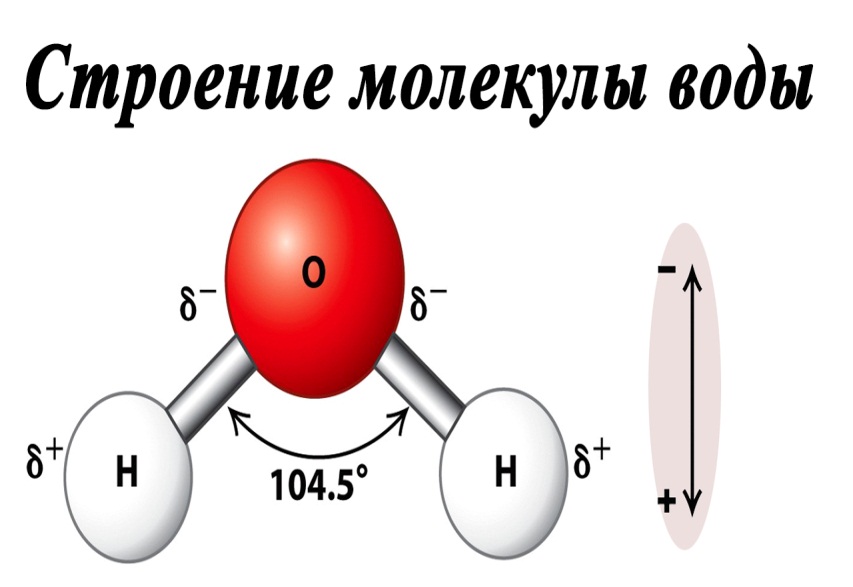
Водородные связи в воде
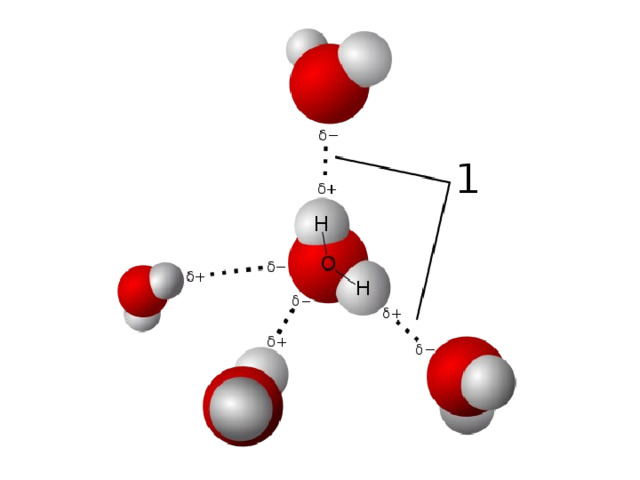
Кластеры воды
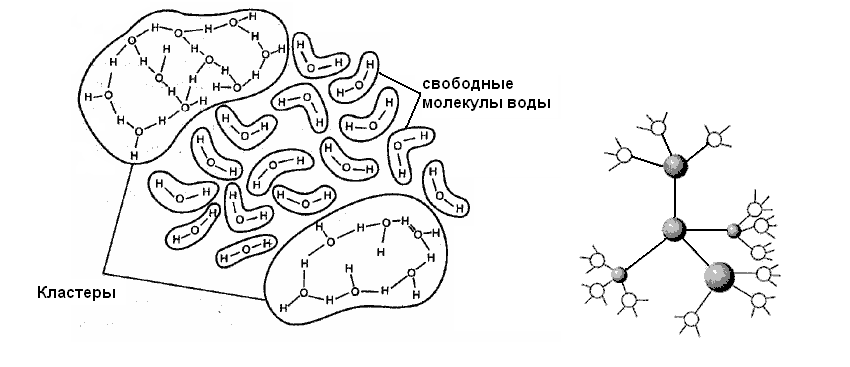
Чтобы попасть каждой молекуле в узел кристаллической решётки нужно разрушить каждый кластер. У холодной воды кластер крупнее и молекулы при распределении в кристалле требуют больше энергии для разрушения кластера, следовательно и процесс замерзания у неё дольше.
Каждые пять минут я снимал показания термометров, результат свёл в график.
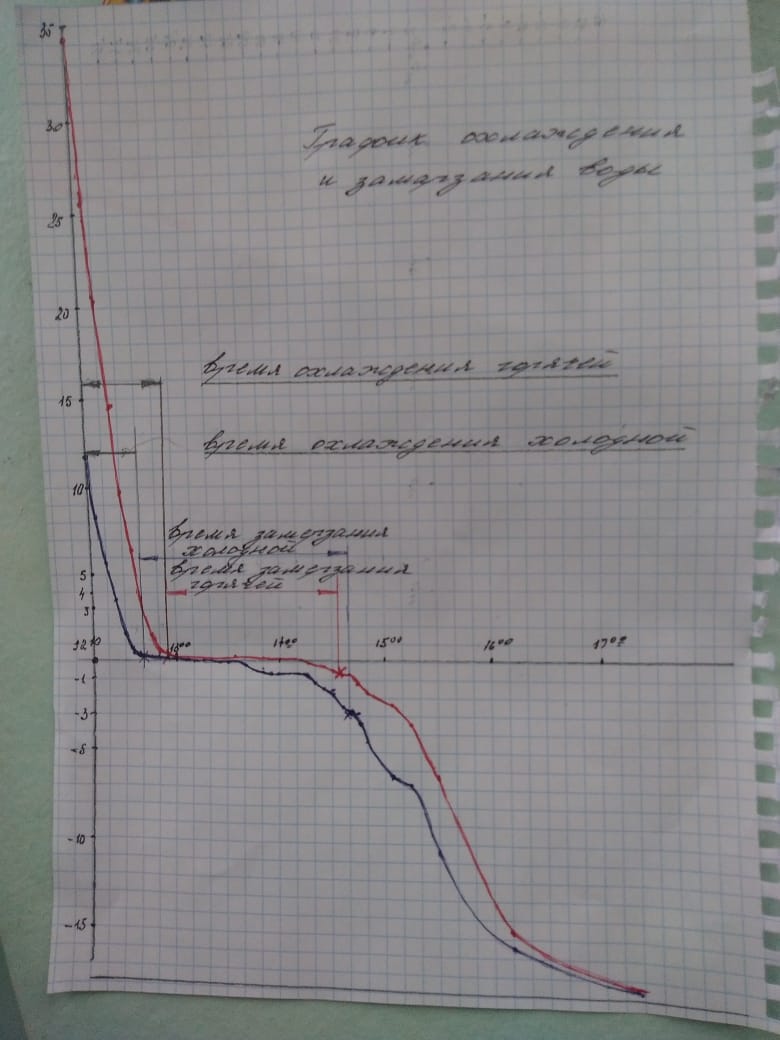
Действительно, более горячая вода замёрзла раньше. Проделав ещё несколько раз такой же опыт, с другими сосудами я заметил, что в некоторых случаях более горячая замерзает раньше, а в некоторых замерзает раньше холодная.

Но во всех опытах время кристаллизации более горячей воды меньше времени кристаллизации более холодной. Мне посоветовали попробовать ронять шарик в ванну с водой и понаблюдать за временем движения шарика в воде, в зависимости от высот с которой сброшен шарик.
Так вот, чем больше высота, с которой падает шарик, тем быстрее он проходит воду.
Однако, в воздухе более высокорасположенный шарик движется дольше. Общее время падения верхнего и нижнего шарика зависит от их положения относительно поверхности воды. Так что, верхний может обогнать нижнего, а может и не догнать. Так же и при замерзании воды. Горячая вода остывает до замерзания дольше, но кристаллизуется быстрее.
Такая аналогия уместна для нагревания, так как скорость увеличивается, и, если сравнивать шарик и молекулу, то температура должна расти, так как она является мерой среднекинетической энергии молекул.
Я провёл ещё один эксперимент. Заморозил одинаковое количество воды в одинаковых сосудах, одну воду замораживал в морозилке до -18 градусов C, другую на улице до -7 градусов С, затем занес их в комнату с температурой +23 градуса.

Каждые три минуты снимал показания термометров, по результатам построил график.
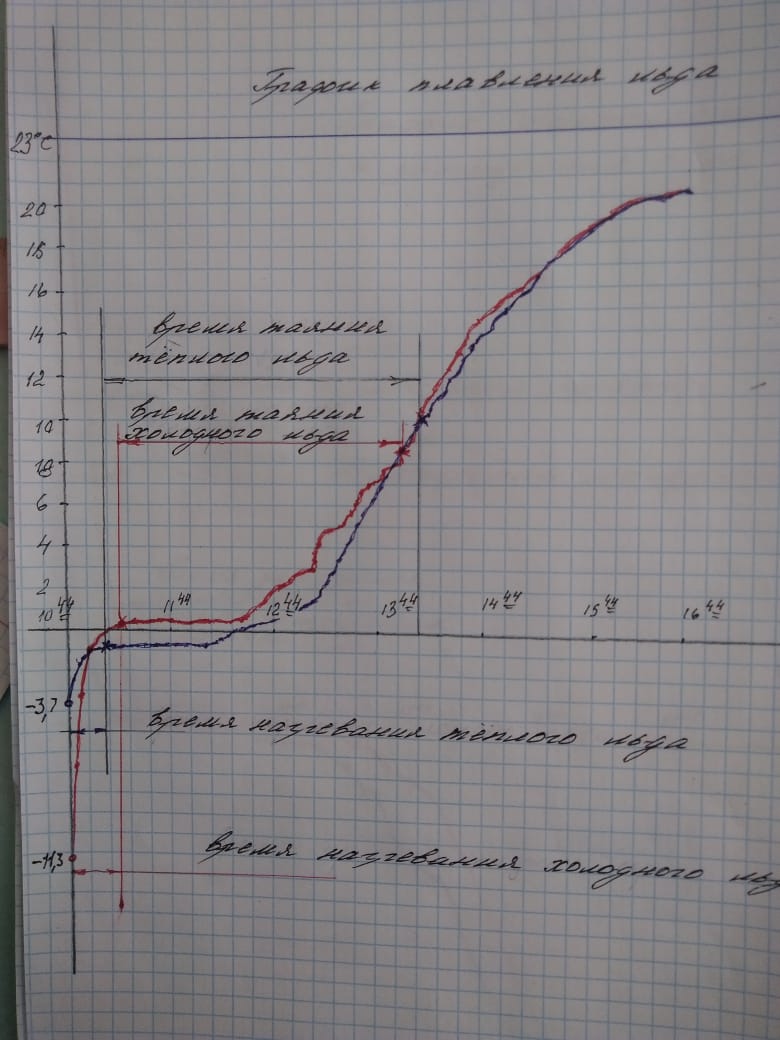
И здесь видно, что время плавления более холодного образца меньше, при том что более тёплый образец начал таять раньше.
Отсюда вывод:
Чем больше разница температур взятого образца воды с температурой замерзания (таяния) тем меньше время фазового перехода.
В своих опытах я увидел как это происходит, осталось выяснить почему происходит именно так.
Нас учили, что все тела состоят из молекул, которые постоянно движутся и взаимодействуют.
Движение молекул характеризуется их кинетической энергией, а взаимодействие-потенциальной.
Соотношение потенциальной энергии и кинетической определяет агрегатное состояние вещества.
Если
Екин значительно больше Епот - то пар
Екин соизмерима с Епот – то жидкость
Екин меньше Епот – то твёрдое тело
Рассказывая про фазовый переход из жидкости в твердое состояние, учитель приводил нам такой пример.
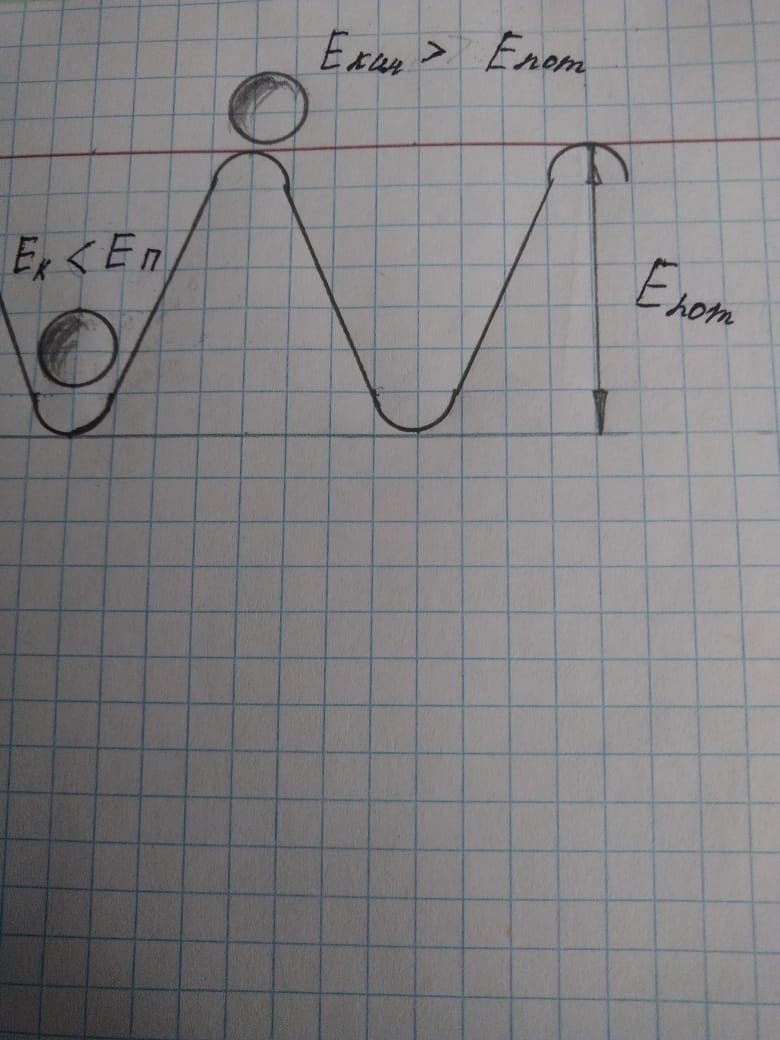
При охлаждении жидкости падает её температура, т. е уменьшается кинетическая энергия молекулы, она не может преодолеть потенциальный барьер и остается на своём месте в узле кристаллической решетки.
И «горячая» и «холодная» молекулы, прежде чем попасть в потенциальную яму должны иметь одинаковую скорость.
И первоначально горячая и первоначально холодная вода при входе в фазу кристаллизации имеют одинаковую температуру, т.е. одинаковую скорость молекул. Разница в том, что более «горячая» молекула изменила свою скорость больше чем «холодная», т.е. её ускорение, в данном случае, замедление или торможение, больше.
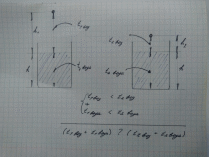
Я решил примерить движение молекулы к движению шарика по криволинейной поверхности
Эксперимент 1:
Схема эксперимента.
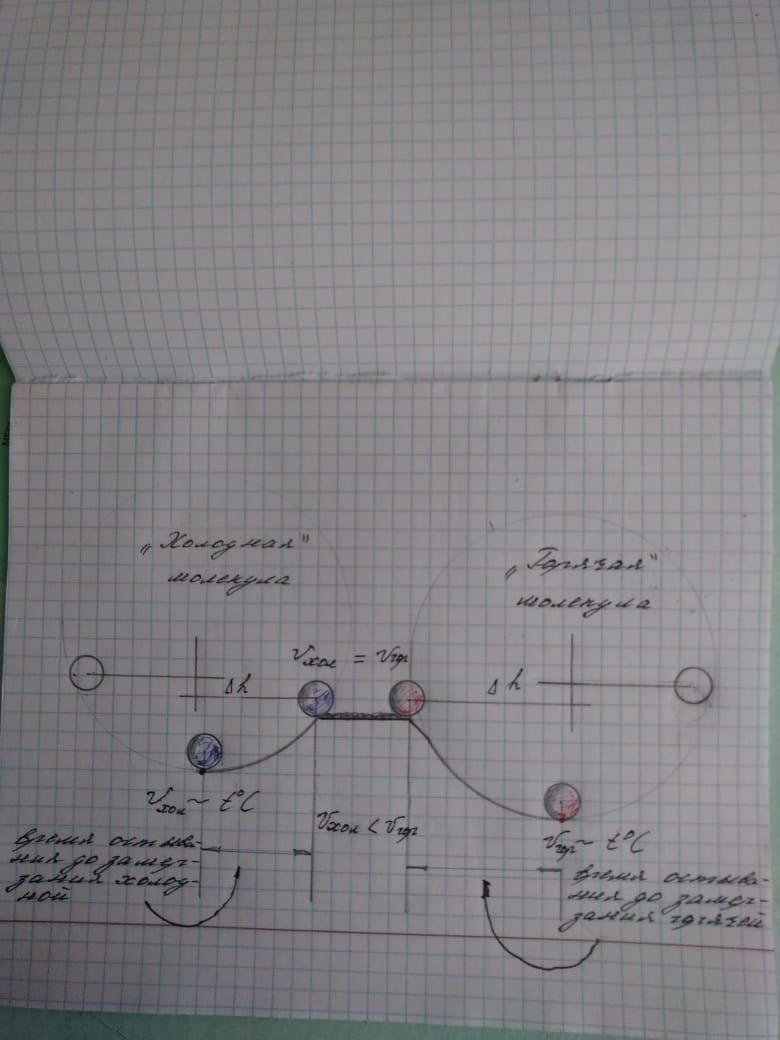
Скорость правого шарика в нижней точке характеризует начальную скорость молекул горячей воды, т.е. её температуру, а скорость левого-холодную.
Скорости на входе в горизонтальный участок будут одинаковые. Это следует из закона сохранения энергии.
Я изготовил такую конструкцию, для увеличения трения покрыл горизонтальный участок тканью.


Я десятки, сотни раз прокатывал различные шарики и цилиндры по этим кривым и убедился, что правый шарик останавливался раньше левого, т.е изначально более горячая молекула быстрее сбросит свою кинетическую энергию и окажется в потенциальной ямке.
Однако, учитель усомнился в чистоте проведенного мной эксперимента по той причине, что горячий шарик проходит больший путь и , следовательно, работа силы трения качения и сопротивления воздуха у него больше и сложно уловить равенство скоростей при входе на горизонтальный участок. И ещё надо очень осторожно относится к шарику, он ведь ещё и вращается. Он предложил мне понаблюдать за движением маятника.
Эксперимент 2
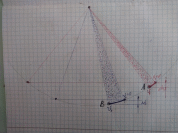
Из закона сохранения энергии следует что скорости шариков в точках А и В одинаковые. Но до остановки шарику А требуется пройти меньшую дугу чем шарику В.
Для наглядности я провел эксперимент на классной доске.

Сначала посчитал фактическое время одного колебания у маятников с большей и меньшей амплитудой, разница составила 0,25 с. Затем отметил точки на траектории с разными скоростями и точки полной остановки шарика. Измерил дуги, на которых шарик тормозил после равенства скоростей. Очевидно, что дуга торможения более «быстрого» шарика меньше дуги более «медленного» и он преодолеет потенциальный барьер быстрее, т.е более «горячая» молекула остановится раньше.
В этих опытах я увидел аналогию в движении шариков и молекул воды во время охлаждения и замерзания. На основании проведенного исследования я сделал вывод:
Более быстрое замерзание горячей воды по сравнению с холодной обусловлено более быстрым торможением молекул горячей воды.
Это явление характерно не только для воды.
Я отрезал кусочек свечи и расплавил его и нагрел расплав до 100 С, при остывании он затвердел за 13 минут.
Когда же я нагрел его до 150 С, то он застывал 8 минут.



Более того, я плавил свинец, но, к сожалению, разницу во времени кристаллизации не заметил – оба образца затвердевали практически мгновенно.
Пожалуй, всё.
Литература:
Учебник А.В. Перышкин 7 класс
Учебник А.В. Перышкин 8 класс
https://ru.wikipedia.org/wiki/%D0%AD%D1%84%D1%84%D0%B5%D0%BA%D1%82_%D0%9C%D0%BF%D0%B5%D0%BC%D0%B1%D1%8B
5