
Соли. Классификация. Физические и химические свойства. Получение и применение солей.

Что такое соли?
Соли– это сложные вещества, образованные атомами металлов и кислотными остатками

Номенклатура солей
Название Название Указание
Кислотного + металла (в Р.п.) + валентности
остатка (если она переменная)
- NaCl хлорид натрия
- CaCO 3 карбонат кальция
- Са 3 (РО 4 ) 2 фосфат кальция
- МgCI 2 хлорид магния

Классификация солей
Растворимые Нерастворимые
Малорастворимые
Аммиачная селитра
NH 4 NO 3 Сульфат кальция
Фосфат железа
FePO 4
CaSO 4
Классификация солей
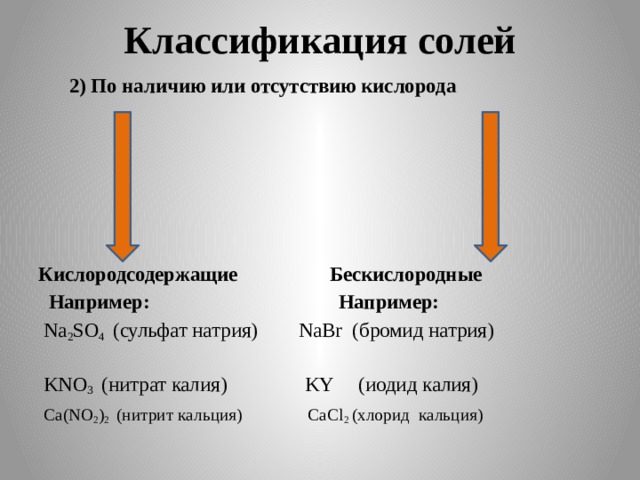
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na 2 SO 4 (сульфат натрия) NaBr (бромид натрия)
KNO 3 (нитрат калия) KY (иодид калия)
Ca(NO 2 ) 2 (нитрит кальция) CaCl 2 (хлорид кальция)
Классификация солей

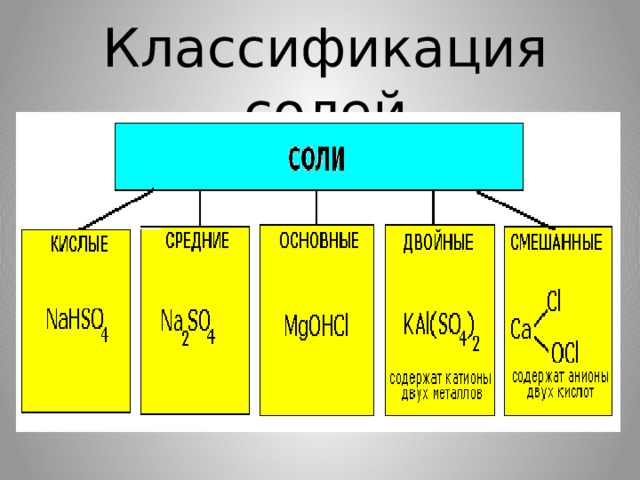
Разновидности солей
Соли бывают:
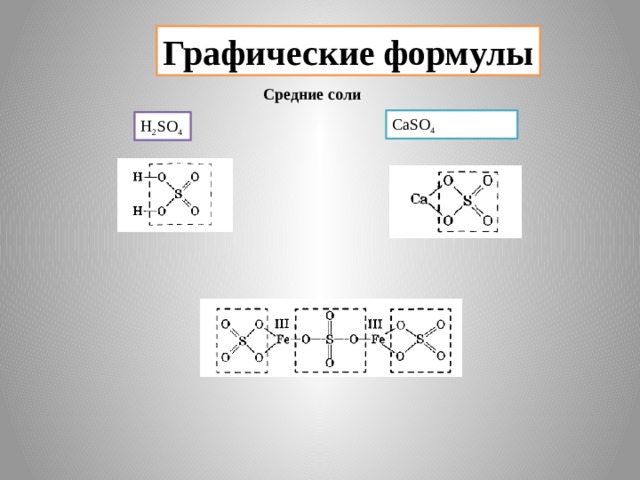
- Средние соли – это продукты полного замещения атомов водорода в кислоте на металл.
Например: Na 2 CO 3 (карбонат натрия)
CuSO 4 (сульфат меди)
Графические формулы
Средние соли
CaSO 4
H 2 SO 4

Разновидности солей
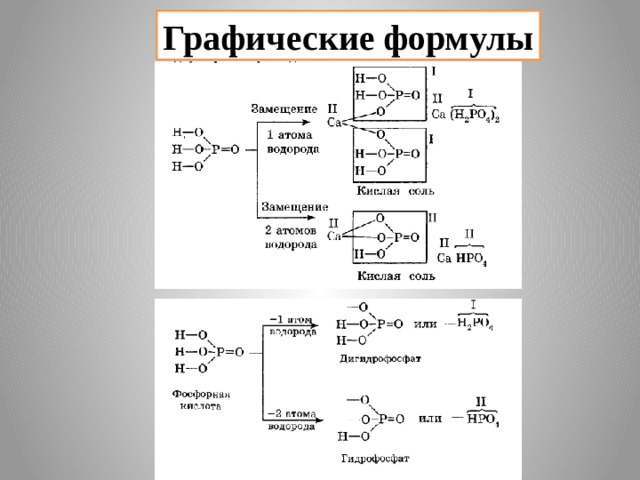
2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
Например:
NaHCO 3 ( гидро карбонат натрия)
Mg(HSO 4 ) 2 ( гидро сульфат магния)
Графические формулы

Разновидности солей
3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например:
(CuOH) 2 CO 3 ( гидроксо карбонат меди (II))
AlOHCl 2 ( гидроксо хлорид алюминия)
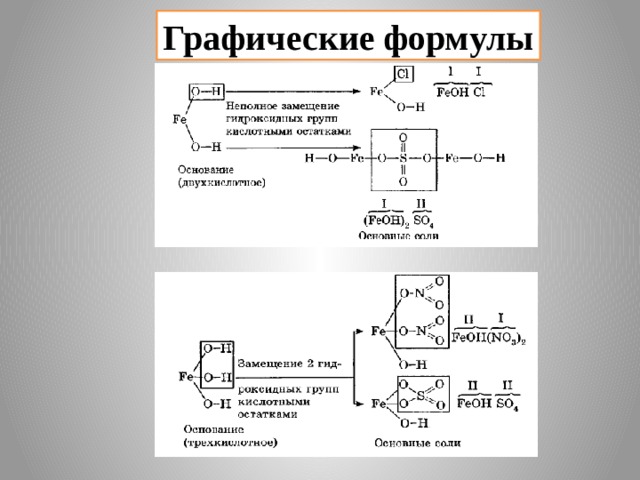
Графические формулы

- Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO 4 ) 2 х12H 2 O)
- Смешанные соли — в их составе присутствует два различных аниона (Ca(OCl)Cl)
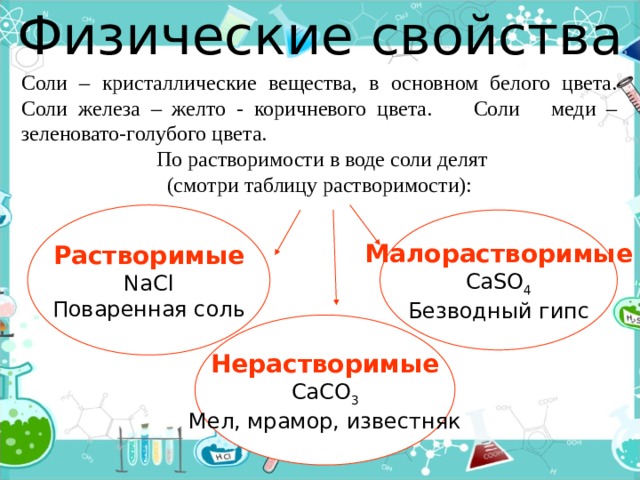
Физические свойства
Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
NaCl
Поваренная соль
Малорастворимые
CaSO 4
Безводный гипс
Нерастворимые
CaCO 3
Мел, мрамор, известняк
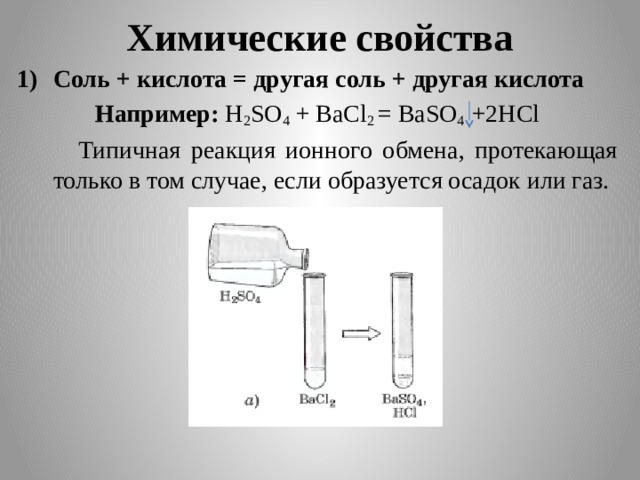
Химические свойства
- Соль + кислота = другая соль + другая кислота
Например: H 2 SO 4 + BaCl 2 = BaSO 4 +2HCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
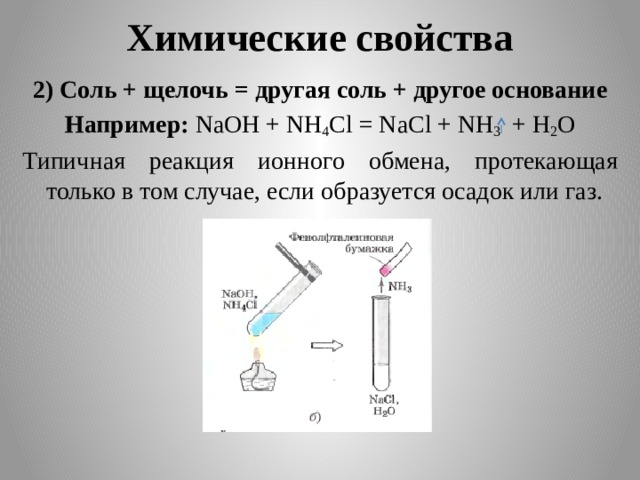
Химические свойства
2) Соль + щелочь = другая соль + другое основание
Например: NaOH + NH 4 Cl = NaCl + NH 3 + H 2 O
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.

Химические свойства
3) Соль 1 + соль 2 = соль 3 + соль 4
Например: Na 2 SO 4 + BaCl 2 = BaSO 4 +2NaCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.

Химические свойства
4) Соль + металл = другая соль + другой металл
Например: CuSO 4 (p-p) + Fe = FeSO 4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.

Способы получения
Основаны на химических свойствах оксидов,
оснований, кислот
- 1. Кислота + основание = соль + вода
H 2 SO 4 +2NaOH = Na 2 SO 4 + 2H 2 O
- 2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL 2 + H 2
- 3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL 2 + H 2 O
- 4. Кислота + соль = новая кислота + новая соль
H 2 SO 4 + BaCL 2 = 2HCL + BaSO 4
Условия: в результате реакции должны получиться газ, осадок или вода.

Способы получения
- 5. Основание + соль = новое основание + новая соль
2 КОН + СаSO 4 = Са(ОН) 2 + К 2 SO 4
- 6. Основание + кислотный оксид + = соль + вода
2NaOH + SO 3 = Na 2 SO 4 + H 2 O
- 7. Кислотный оксид + основный оксид = соль
СО 2 + СаО = СаСО 3
- 8. Соль + соль = новая соль + новая соль
КСl + AgNO 3 → AgCl + KNO 3
- 9. Соль + металл = новая соль + металл
CuSO 4 + Fe = FeSO 4 + Cu
- 10. Металл + неметалл = соль
Fe +S = FeS

Применение солей
- - в стирке, с помощью порошка, с состав которого входит стиральная (кальцинированная) сода – Na 2 CO 3 ;
- - удобрения, которые мы вносим в почву – NH 4 NO 3 - аммиачная селитра; CaHPO 4 - простой суперфосфат и другие.
- - в домашней аптечке – ляпис AgNO 3
- - СuSO 4 - медный купорос, который добавляют в побелку, применяют против болезней и вредителей растений.
- да и сам наш организм содержит соли, в костях – Ca 3 (PO 4 ) 2

Применение солей
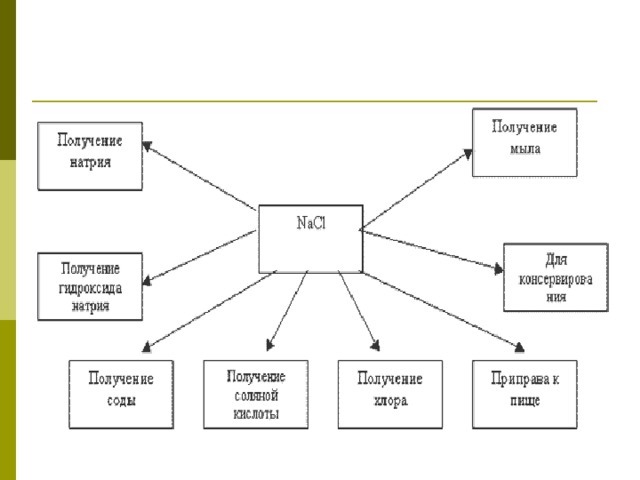
- Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.

Применение солей
- Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.

Применение солей
- Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.

Применение солей
- Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Применение NaCl

Мрамор, известняк, мел

ИЗДЕЛИЯ ИЗ МАЛАХИТА

Обобщение темы
Тест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl б) Ca(OH) 2
в) Na 2 SO 4 г) MgО
2) Какая из приведенных солей растворима в воде:
а) AgCl б) MgS
в) FePO 4 г) CuSO 4
3) Какая из приведенных солей бескислородная:
а) CаSO 4 б) KBr
в) NH 4 NO 3 г) Na 2 CO 3

4) К какому типу солей относится данная соль - AlOHCl 2 :
а) средняя б) основная
в) кислая г) ни к одной из этих
5) Какая реакция не является типичной реакцией для средних солей:
а) соль + металл б) соль + кислота
в) соль + оксид г) соль + щелочь
.

Задания для самостоятельной работы

























































