Тема урока:
Строение атома

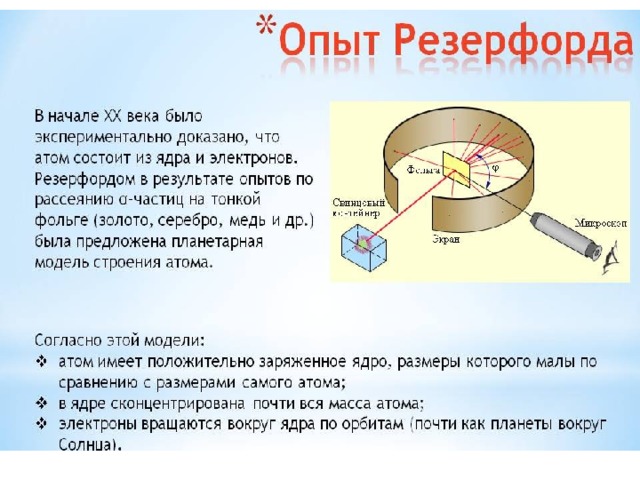

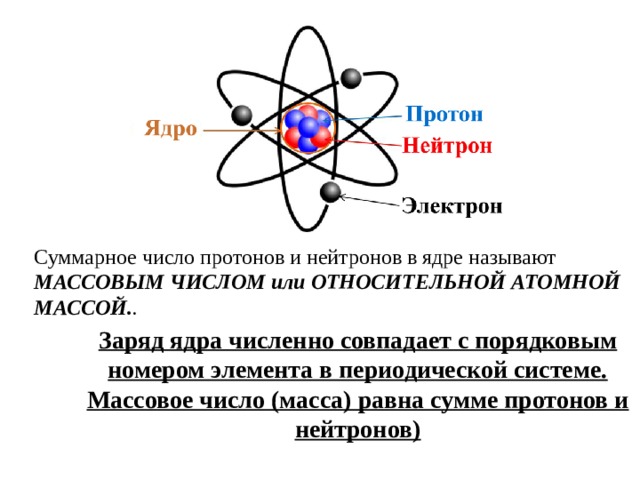
Суммарное число протонов и нейтронов в ядре называют МАССОВЫМ ЧИСЛОМ или ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССОЙ. .
Заряд ядра численно совпадает с порядковым номером элемента в периодической системе.
Массовое число (масса) равна сумме протонов и нейтронов)
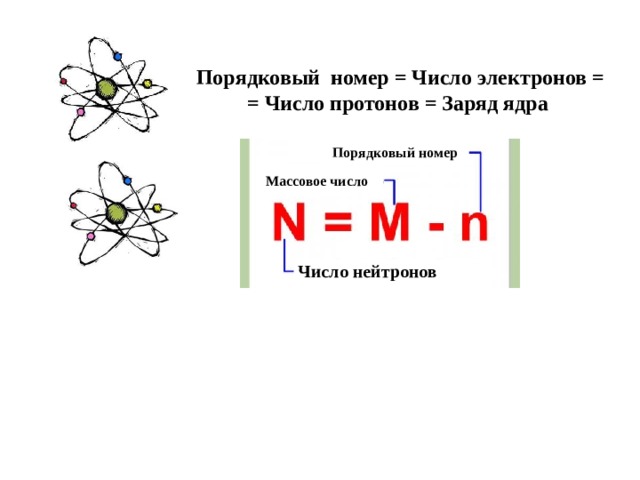
Порядковый номер = Число электронов = = Число протонов = Заряд ядра
Порядковый номер
Массовое число
Число нейтронов
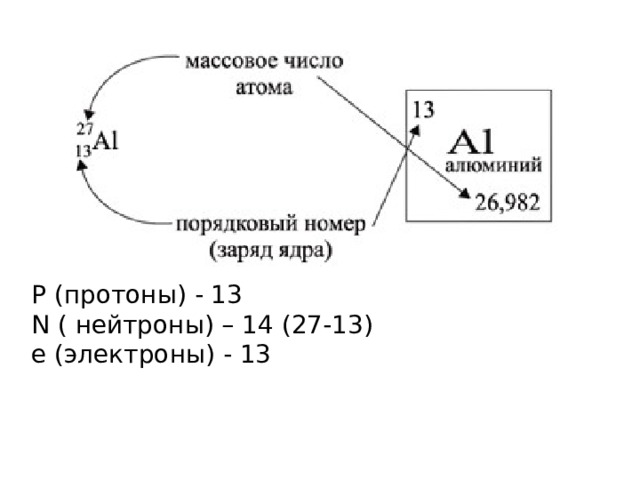
Р (протоны) - 13
N ( нейтроны) – 14 (27-13)
е (электроны) - 13

Показать массовое число и заряд ядра, количество электронов, протонов и нейтронов для натрия, серы, марганца.
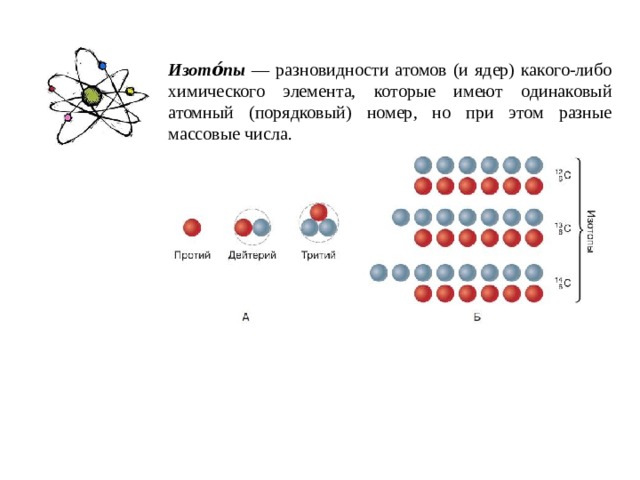
Изото́пы — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа.
Химический элемент – это вид атомов с одинаковым зарядом ядра.

Распределение электронов по энергетическим уровням
- Теперь, когда мы знаем состав атома, выясним, как располагаются электроны вокруг атомных ядер.
- Электроны обладают некоторым запасом энергии, которую они поглощают или излучают определенными порциями.
- Соответственно запасу энергии электроны располагаются на определенных энергетических уровнях
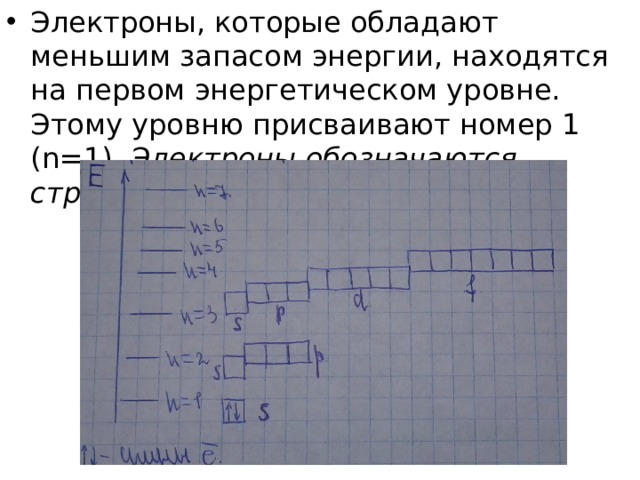
- Электроны, которые обладают меньшим запасом энергии, находятся на первом энергетическом уровне. Этому уровню присваивают номер 1 (n=1). Электроны обозначаются стрелочками

- Наибольшее число электронов на энергетическом уровне определяется по формуле: N=2n 2
Где N –максимальное число электронов
n – номер энергетического уровня, равен порядковому номеру периода.
2 уровень
1 уровень
3 уровень
4 уровень
2 электрона
8 электронов
2*1 2 = 2
2*2 2 = 8
18 электронов
32 электрона
2*3 2 = 18
2*4 2 = 32

На внешнем энергетическом уровне может находиться не более 8 электронов!
+
Внешний уровень – 8 электронов у элементов 3-го периода
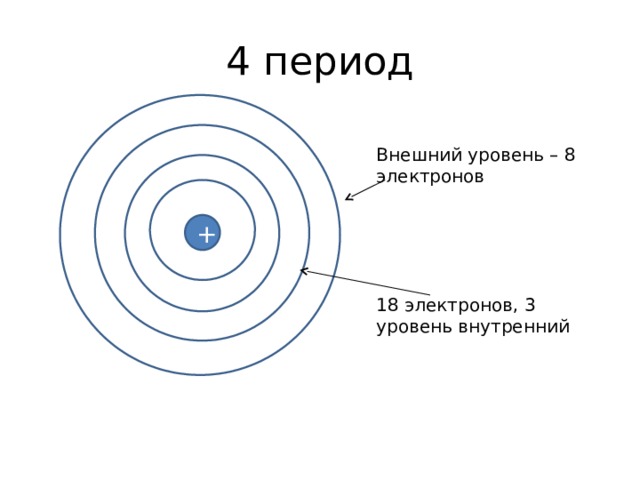
4 период
Внешний уровень – 8 электронов
+
18 электронов, 3 уровень внутренний
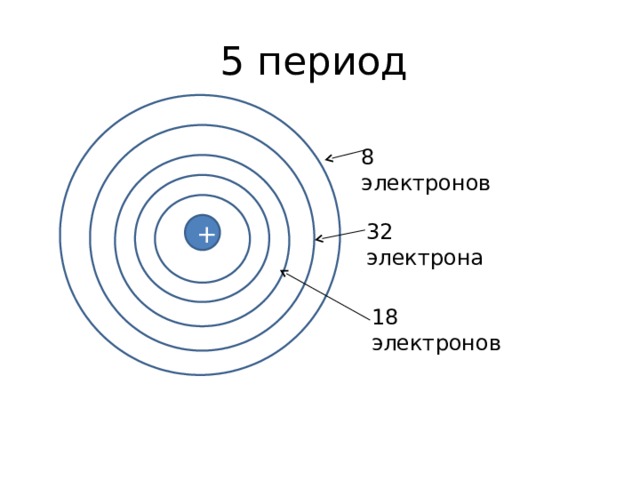
5 период
8 электронов
+
32 электрона
18 электронов

- ИСКЛЮЧЕНИЕ:1 энергетический уровень имеет не более 2-х электронов, независимо внутренний он, или единственный у атома.
- Число электронов на внешнем энергетическом уровне равно номеру группы, для элементов главных подгрупп. У побочных – 2 электрона.
- ПРИМЕР:
Незавершенный, здесь находится не максимальное число электронов. Их еще называют валентные электроны
Завершенные уровни – там находится максимальное число электронов

Орбитали (подуровни)

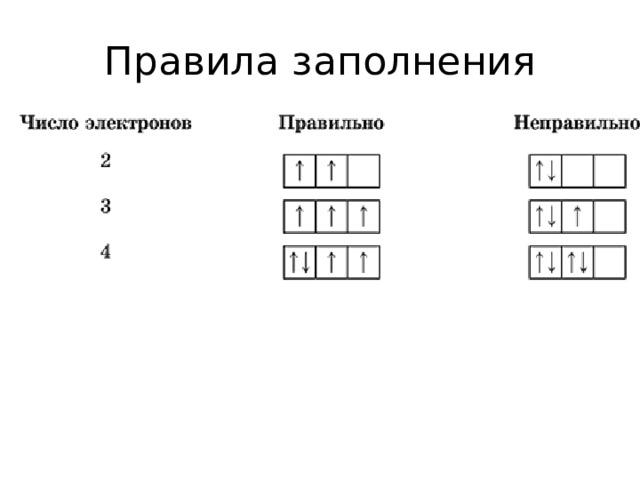
Правила заполнения

ПРИМЕР: Изобразите схему строения атома азота.
- 1. Необходимо найти атом в таблице Менделева
- 2. Определить его порядковый номер ( а он равен количеству электронов)
- 3. Определить в каком периоде находится элемент
- 4. Изобразить схему.
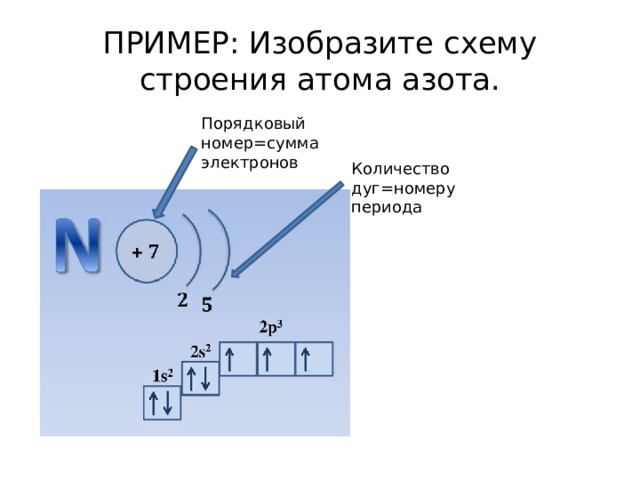
ПРИМЕР: Изобразите схему строения атома азота.
Порядковый номер=сумма электронов
Количество дуг=номеру периода















































