18
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
При исследовании водных растворов солей, кислот и оснований было обнаружено, что они имеют целый ряд особенностей.
Одна из особенностей водных растворов солей, кислот и оснований заключается в том, что экспериментальное значение величины осмотического давления, понижение давления пара, изменение температуры кипения и замерзания растворов солей, кислот и оснований всегда больше, чем теоретически вычисленные (исходя из концентрации раствора) соответствующие значения.
Значение Δtкристалл для 0,2 н раствора некоторых солей
| Соль | Δtкристалл (теоретически вычислена по закону Рауля) | Δtкристалл (экспериментально измерена) |
| КСl | 0,372 | 0,673 |
| KNO3 | 0,372 | 0,664 |
| MgCl2 | 0,186 | 0,519 |
Указанные свойства зависят от числа частиц растворенного вещества. Следовательно, можно предположить, что если эти значения увеличились, то значит увеличилось число и частиц в растворе.
Растворы солей, кислот и оснований проводят электрический ток. Но в безводном состоянии большинство из них плохо проводят электрический ток. Вода также плохо проводит электрический ток.
Данные факты дают основания предположить, что при образовании растворов соли, кислоты и основания претерпевают какие-то изменения, в результате которых у них возникает высокая электрическая проводимость.
Особенности растворов солей, кислот и оснований объяснил Сванте Август Аррениус в 1887 г. Он выдвинул гипотезу электролитической диссоциации. В дальнейшем данная гипотеза была подтверждена экспериментально и развивалась многими учеными на основе учения о строении атома и химической связи (работы И.А. Каблукова, В.А. Кистяковского, Д.И. Менделеева и др.).
Современное содержание теории электролитической диссоциации сводится к трем основным положениям:
1. При растворении солей, кислот и оснований в воде или при их расплавлении происходит распад (диссоциация) этих веществ на ионы.
Ионы — это атомы или группы атомов, имеющие заряд.
Ионы, имеющие положительный заряд, называются катионы (Н+, NH4+, Na+)
Ионы, имеющие отрицательный заряд, называются анионы (ОН-, Сl-, NO3-).
Свойства ионов совершенно иные, чем у образовавших их атомов. Например, атомы металлического натрия Na энергично разлагают воду с выделением водорода, в то время как ионы натрия Na воду не разлагают. Атомы хлора образуют двухатомные молекулы, которые имеют желто-зеленый цвет и резкий запах. Хлорид-ионы Сl- — бесцветны и не имеют запаха.
| ИОНЫ | простые (Na+, Mg2+, S2- , Cl-) |
| сложные (NO3-, NH4+, SO42-) |
В растворе ионы беспорядочно передвигаются («странствуют») в различных направлениях. Само название «ион» в переводе с греческого означает «странствующий».
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду, т. е. проводят электрический ток.
Вещества, которые проводят электрический ток своими ионами, называются электролиты.
3. Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация или диссоциация) и соединение ионов в молекулы (моляризация или ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Например, в общем виде уравнение диссоциации записывается так:
Аn+Вm- ↔ nА+ + mВ-
диссоциация
Mg2+(NO3-)2 ↔ Mg2+ + 2NO3-
моляризация
Механизм диссоциации
Объяснить механизм электролитической диссоциации помогает учение о химической связи.
Наиболее типичны два случая диссоциации: диссоциация веществ с ионной связью; диссоциация веществ с ковалентной полярной связью.
Диссоциация веществ с ионной связью (диссоциация солей)
Когда кристалл соли, например хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными. Но если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.

Диссоциация веществ с ковалентной полярной связью (диссоциация кислот)
В этом случае вокруг полярной молекулы вещества ориентируются диполи воды, которые притягиваются своими отрицательными полюсами к положительному полюсу молекулы и положительными полюсами — к отрицательному полюсу. В результате этого взаимодействия в растворенном веществе общая электронная пара полностью смещается к атому с большей электроотрицательностью. Полярная молекула превращается в «ионную» и распадается на ионы под действием непрерывного теплового движения окружающих ее молекул воды.

1 — полярная молекула в начале гидратации; 2 — переход полярной структуры в ионную под действием диполей воды; 3 — гидратированный катион; 4 — гидратированный анион
Как в случае диссоциации веществ с ионной связью, так и в случае веществ с ковалентной полярной связью ионы, перешедшие в раствор, остаются связанными с молекулами воды и образуют гидратированные ионы.
Гидратированные ионы — это соединения ионов с молекулами воды.
Например, ион водорода в водных растворах существует исключительно в виде комплексов с молекулами воды (Н+*Н2O, Н+*2Н2O, Н+*3Н2O, Н+*4Н2O).
Это объясняется тем, что ион водорода Н+:
• имеет очень маленькие размеры (составляет 10-4 от размера атома);
• не имеет электронной оболочки;
• не испытывает отталкивания от электронных оболочек других атомов.
Самый устойчивый из всех комплексов иона водорода с молекулами воды — ион гидроксония.
Н+ + Н2О = Н3О+.
Образование иона гидроксония происходит по донорно-акцепторному механизму.
С образованием иона гидроксония связана исключительно высокая подвижность иона водорода в водных растворах, а значит и его влияние на разнообразные химические реакции.
Таким образом, главной причиной диссоциации является гидратация (в случае неводных растворителей сольватация) ионов.
Степень диссоциации. Сила электролитов
Количественной характеристикой процесса диссоциации является степень диссоциации.
Степень диссоциации () — это отношение числа молекул, распавшихся на ионы (n), к общему числу молекул растворенного вещества (N):
 .
.
Так, запись = 82% означает, что из 100 молекул растворенного вещества 82 распадаются на ионы. В зависимости от степени диссоциации электролиты условно делятся на три группы: сильные, средние и слабые (Степень диссоциации электролита определяют экспериментально по электропроводности 0,1 н раствора данного вещества при 250С).
Сильные электролиты имеют степень диссоциации более 30%, слабые электролиты — менее 3%. Электролиты со степенью диссоциации в пределах от 3 до 30% являются электролитами средней силы.
| Классы веществ | Сильные электролиты | Слабые электролиты | Электролиты средней силы |
| 30% | | от 3 до 30% |
| Кислоты | НСlO4, НСl, HBr, HI, HNO3, H2SO4 H2SeO4, НМnO4 НВrO3, НIO3, H2Cr2O7 | H2S, H2CO3, H2SiO3, HNO2, HCN, H3BO3 CH3COOH и другие органические кислоты | HF, H2SO3, Н3РO4 |
| Основания | Ca(OH)2, LiOH, NaOH, KOH, RbOH, CsOH, Sr(OH)2, Ba(OH)2 | NH4OH, нерастворимые основания | Mg(OH)2 Ве(ОН)2 |
| Соли | растворимые соли | нерастворимые соли |
|
Степень диссоциации электролита в водном растворе зависит'.
1. от природы растворителя: чем более полярна молекула растворителя, тем выше степень диссоциации,
2. природы электролита;
3. температуры: при повышении температуры степень диссоциации увеличивается.
Повышение температуры приводит к увеличению кинетической энергии движения всех частиц в растворе и молекуле электролита. Это приводит к более эффективному разрыву молекул на ионы. В результате чего степень диссоциации увеличивается.
4. от концентрации: при разбавлении раствора степень диссоциации увеличивается.
При разбавлении раствора степень диссоциации увеличивается, так как уменьшается вероятность эффективного столкновения разноименных ионов.
Особенности растворов слабых электролитов
Слабые электролиты диссоциируют на ионы не полностью. Поэтому в их растворах устанавливается динамическое равновесие между молекулами, которые не распались на ионы, и ионами.
В уравнении процесса электролитической диссоциации слабого электролита ставят знак обратимости ↔.
К процессу диссоциации слабого электролита можно применить законы химического равновесия и записать выражение константы равновесия, которая в данном случае будет называться константой диссоциации Кд:
Аn+Вm- ↔ nА+ + mВ-
 .
.
где [А+] и [В-] — равновесные концентрации ионов; [АnВm] — равновесная концентрация молекул АnВm, которые не распались на ионы.
Константа диссоциации зависит:
1) от природы растворителя;
2) от температуры.
Константа диссоциации не зависит от концентрации раствора.
Связь между степенью диссоциации и константой диссоциации выражается законом разбавления (закон разбавления Оствальда):
 .
.
Представленное уравнение дает возможность вычислить степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Пользуясь этим уравнением, можно так же вычислить константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала («1), уравнение закона Освальда упрощается: величиной в знаменателе уравнения КД можно пренебречь. Тогда уравнение принимает вид
КД = 2*С
или
 .
.
Это уравнение наглядно показывает, что степень диссоциации возрастает при разбавлении раствора.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато — вначале от молекулы отщепляется один из ионов, затем другой и т. д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации.
Например, ортофосфорная кислота Н3РO4 имеет три ступени диссоциации и три значения констант диссоциации:
I. 
II. 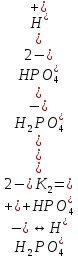
III. 
H3PO4 ↔ 3H+ + PO43-
Значения констант диссоциации (К1, К2, К3) ясно показывают, что по первой ступени диссоциации ортофосфорная кислота — электролит средней силы, по второй — слабая, а по третьей — очень слабая.
По второй ступени диссоциации ортофосфорная кислота является более слабой, чем угольная. Константа диссоциации угольной кислоты по первой ступени диссоциации при 25 °С равна:
 .
.
По третьей ступени диссоциации ортофосфорная кислота является даже более слабой, чем сероводородная. Константа диссоциации сероводородной кислоты по первой ступени диссоциации при 25 °С равна:

При ступенчатой диссоциации распад вещества по последующей ступени всегда происходит в меньшей степени, чем по предыдущей: К1 К2 K3…
Это объясняется тем, что на первой стадии ион отщепляется от нейтральной молекулы. На второй стадии — от иона, что требует большей затраты энергии, так как приходится преодолевать силу притяжения. К тому же диполь воды может атаковать ион только противоположно заряженным концом. На третьей стадии ион отщепляется также от иона, но с большим зарядом.
Особенности растворов сильных электролитов
Поведение сильных электролитов значительно отличается от поведения слабых электролитов.
Сильные электролиты в водных растворах практически полностью диссоциируют на ионы (степень их диссоциации близка к 100%).
В уравнении процесса электролитической диссоциации сильного электролита ставят знак →.
Экспериментальные данные показывают, что степень диссоциации сильных электролитов меньше 100%. Например, определяемая экспериментальными методами (по электрической проводимости, по давлению насыщенного пара над раствором, по температуре кипения и замерзания) для NaOH равна 82%.
Степень диссоциации сильных электролитов, определенная экспериментальными методами, называется кажущейся степенью диссоциации
Значение кажущейся степени диссоциации для NaOH, равное 82%, означает, что только 82% молекул NaOH подвергаются диссоциации. Остальные 18% молекул на ионы не распадаются. В то же время никаких экспериментальных данных, указывающих на наличие в растворе сильного электролита молекул, нет (хотя концентрация 18% вполне достаточна для их обнаружения).
Отклонение значения от 100% можно объяснить следующими фактами.
Во-первых, определение степени диссоциации, исходя из величины давления насыщенного пара над раствором, температуры кипения и замерзания, основано на представлении, что раствор идеален. Приложение теории идеальных растворов к реальным растворам приводит к различным отклонениям в расчетах.
Во-вторых, ионы взаимодействуют с молекулами растворителя (сольватация). В результате вокруг иона образуется оболочка из молекул растворителя. Это замедляет перемещение иона в электрическом поле, что приводит к снижению электропроводности и степени диссоциации. Однако основная причина сильного отклонения степени диссоциации сильных электролитов в растворе от 100% связана с представлениями об ионной атмосфере.
В растворах слабых электролитов концентрация ионов мала, расстояние между ними велико, взаимодействие ионов друг с другом незначительно. В растворах сильных электролитов концентрация ионов гораздо выше, расстояние между ними гораздо меньше. Поэтому силы притяжения и отталкивания между ионами достаточно велики. Другими словами, в каждый момент времени вокруг любого иона формируется оболочка из ионов противоположного заряда — ионная атмосфера. В отсутствии внешнего электрического поля ионная атмосфера симметрична (а). Но под действием внешнего электрического поля ионы с различными зарядами будут двигаться в противоположных направлениях. Ион стремится в одну сторону, а окружающая его ионная атмосфера — в другую (б). Такая асимметрия ионной сферы вызывает торможение движения иона через раствор, т. е. понижает его электропроводность. В результате, по данным электропроводности, число ионов кажется меньше, чем в действительности. А значит и оказывается меньше 100%.


Образование ионной атмосферы объясняет то, что к диссоциации сильных электролитов нельзя применить закон действующих масс и написать выражение константы диссоциации (в выражение константны диссоциации входят концентрации свободных ионов, которых в реальных растворах нет).
Различные электростатические взаимодействия между ионами в растворах сильных электролитов математически отражает ионная сила раствора.
Ионная сила — это полусумма произведений концентраций всех имеющихся в растворе ионов на квадрат их заряда:
 .
.
Например, ионная сила 1 М раствора La2(SO4)3 составляет:
La2(SO4)3 = 2La3+ + 3SO42-
I = 1/2(C(La3+)z2(La3+) + C(S042-)z2(S042-)) = 1/2(2*32 + 3*22) = 15.
Если раствор содержит несколько электролитов в разных концентрациях, то при вычислении ионной силы учитывают вклад всех ионов в ионную силу раствора.
Например, вычислим ионную силу раствора, содержащего 0,1 моль/л хлорида натрия и 0,1 моль/л хлорида бария. Концентрация ионов Na+ (C1) равна соответственно 0,1 моль/л, z1 - 1. Концентрация ионов Ва2+ (С2) равна 0,1 моль/л, z2 = 2. Общая концентрация ионов хлора Сl- (С3) составляет 0,1 + 0,1*2 = 0,3 моль/л, z3 = -1. Таким образом, I = 1/2(0,1*12 + 0,1*22 + 0,3(-1)2) = 1/2 (0,1+0,4+0,3) = 0,4.
Для учета межионных и межмолекулярных взаимодействий в растворах сильных электролитов используют величину, которая называется активность.
Активность иона (а) - это условная концентрация иона, в соответствии с которой он действует при химических реакциях.
Активность отражает суммарно все эффекты взаимодействия ионов между собой и с молекулами растворителя.
Активность — это мера реального поведения вещества в растворе.
Активность иона а связана с его концентрацией с через коэффициент активности f формулой: а = cf.
Коэффициент активности отражает степень отклонения поведения реального раствора от идеального.
Коэффициенты активности различных ионов различны и зависят от условий. Для водных растворов при 25 °С коэффициент активности иона f с зарядом z зависит от ионной силы раствора I: lgf=-0,51z2√I.
Если пользоваться значениями активности ионов, то законы химического равновесия можно применить и к сильным электролитам. Например:
NaCl → Na+ + Cl-;
 .
.
Константа равновесия, вычисленная по концентрациям веществ, участвующих в равновесии, называется аналитической константой. Константа равновесия, вычисленная по активности веществ, называется термодинамической константой.
Определение кислот, солей и оснований с точки зрения теории электролитической диссоциации
Кислоты — это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н+. Например:
HNO3 → Н+ + NO3-.
Слабые многоосновные кислоты диссоциируют ступенчато:
I. Н2СO3 ↔ Н+ + НСO3-
II. НСO3 ↔ Н+ + СO32-
Н2СО3 ↔ 2Н+ + СO32-.
Основания — это электролиты, при диссоциации которых в качестве анионов образуются только анионы гидроксогрупп ОН-.
NaOH → Na+ + ОН-
Слабые многокислотные основания диссоциируют ступенчато:
I. Mg(OH)2 ↔ ОН- + MgOH+
II. MgOH+ ↔ OH- + Mg2+
Mg(OH)2 ↔ Mg2+ + 2OH-.
Амфотерные гидроксиды — это электролиты, которые при диссоциации образуют катионы водорода Н+ и гидроксид-анионы ОН-, т. е. диссоциируют по типу кислоты и по типу основания.
Zn2+ + 2OН- ↔ Zn(OH)2 ↔ H2ZnO2 ↔ 2Н+ + ZnO22-.
Соли — это электролиты, при диссоциации которых в качестве катионов образуются катионы, отличные от катионов водорода, а в качестве анионов — анионы, отличные от анионов ОН--групп.
Средние соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
К2СO3 → 2К+ + СO32-;
Al2(SO4)3 → 2Аl3+ + 3SO42-.
Кислые соли — электролиты, которые диссоциируют на катион металла и сложный анион (содержит катион водорода в составе кислотного остатка).
NaHCO3 → Na+ + HCO3-.
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы (состоят из атомов металла и гидроксогрупп ОН)-.
ZnOHNO3 → ZnOH+ + NO3-.
Реакции ионного обмена
В водных растворах все электролиты в той или иной степени подвергаются диссоциации, т. е. распадаются на ионы под действием полярных молекул растворителя. Поэтому все реакции в водных растворах электролитов являются реакциями не между молекулами, а между ионами.
Если реакции между ионами не сопровождаются изменением степени окисления, то они называются реакциями ионного обмена.
При взаимодействии ионов энергия активации очень мала, поэтому такие реакции протекают с очень большими скоростями.
Реакции ионного обмена принято изображать в виде ионных уравнений (молекулярное, полное ионное, сокращенное ионное).
При составлении полного ионного уравнения слабые электролиты, малорастворимые и газообразные вещества изображают в виде молекул. Сильные растворимые электролиты, как практически полностью диссоциированные, пишут в виде ионов.
Сокращенное ионное уравнение в отличие от молекулярного относится не к одной реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом — его большая практическая ценность.
Например, рассмотрим реакцию взаимодействия карбоната натрия и соляной кислоты. Запишем уравнение реакции в молекулярном виде:
Na2CO3 + 2НСl → 2NaCl + Н2O + CO2↑.
При составлении полного ионного уравнения молекулы воды записывают в недиссоциированной (молекулярной) форме, потому что она является слабым электролитом. Неполярные молекулы СO2 плохо растворимы в воде и удаляются из сферы реакции. Полное ионное уравнение, соответственно, имеет вид
Na+ + CO32- + 2Н+ + 2Сl- → 2Na+ + 2Сl- + Н2O + СO2.
Сократив одинаковые ионы в обеих частях уравнения, получим сокращенное ионное уравнение
CO32- + 2Н+ → Н2O + СO2.
Сокращенное ионное уравнение показывает, что сущность реакции сводится к взаимодействию карбонат-ионов CO32- с протонами водорода Н+, в результате чего образуются углекислый газ и вода.
Очевидно, что подобным уравнением будет описываться взаимодействие карбонат-ионов с любой кислотой.
Многочисленные реакции ионного обмена в растворах электролитов, которые протекают практически необратимо в сторону образования продуктов реакции, можно разбить на три группы:
1. Реакции с образованием осадков. Например:
AgNO3 + HCl → AgCl↓ + HNO3.
Полное ионное уравнение:
Ag+ + NO3- + Н+ + Сl- → AgCl↓ + Н+ + NO3-.
Сокращенное ионное уравнение:
Ag+ + Сl- → AgCl↓.
2. Реакции с образованием газообразных (легколетучих) малорастворимых веществ. Например:
Na2CO3 + H2SO4 → Na2SO4 + Н2O + CO2↑.
2Na+ + CO32- + 2H+ + SO42- → Na+ + SO42- + H2O + CO2↑.
CO32- + 2Н+ → Н2O + СO2.
3. Реакции с образованием малодиссоциирующих веществ (слабых электролитов). Например:
НСl + КОН → KCl + H2O.
Н+ + Сl- + К+ + ОН- → K+ + Cl- + H2O.
Н+ + OН- → Н2O.
Вышеизложенное позволяет сформулировать правило, которым руководствуются при изучении реакций ионного обмена.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов или слабых электролитов.
Если исходными веществами являются сильные электролиты и при их смешивании не образуется осадок, газ или слабый электролит, то такие реакции не протекают в растворе. Например, взаимодействие нитрата калия и хлорида натрия в растворе выражается уравнением:
KNO3 + NaCl → КСl + NaNO3.
Полное ионное уравнение имеет вид
K+ + NO3- + Na+ + Cl- → К+ + Сl- + Na+ + NO3-.
Написать сокращенное ионное уравнение в случае данной реакции нельзя. Согласно теории электролитической диссоциации, реакция не протекает, образуется равновесная система, в которой одновременно находятся все ионы.
Ионное произведение воды. Водородный показатель
Вода — слабый амфотерный электролит.
Уравнение диссоциации воды имеет вид Н2O ↔ Н+ + ОН-.
В воде и водных растворах ионы водорода Н+ связываются с молекулами воды, образуя комплексные гидратированные ионы. Поэтому уравнение диссоциации воды правильнее было бы представить как: 2Н2O ↔ Н3O+ + ОН-.
Константа диссоциации воды равна:
 1,8*10-16 (при 25°С).
1,8*10-16 (при 25°С).
Значение КД очень мало. Поэтому концентрацию молекул воды [Н2O] можно считать величиной постоянной. Численно она равна общему количеству молей в 1 л воды:
 .
.
Преобразуем уравнение КД воды:
КД*[Н2O] = [Н+]*[OН-],
КД*[Н2O] = 1,8*10-16*55,56 = 10-14.
Обозначив КД*[Н2O] =  , получим:
, получим:  = [Н+]*[OН-] = 10-14 моль2/л2.
= [Н+]*[OН-] = 10-14 моль2/л2.
 постоянная величина, которая называется ионным произведением воды.
постоянная величина, которая называется ионным произведением воды.
Ионное произведение воды показывает, что произведение концентраций ионов Н+ и ОH--групп в воде и водных растворах постоянно и при температуре 25°С равно 1*10-14моль2/л2.
 — величина постоянная лишь при постоянной температуре. С повышением температуры значение ионного произведения воды возрастает, так как при этом возрастает степень электролитической диссоциации воды и, соответственно, концентрации ионов Н+ и ОН-.
— величина постоянная лишь при постоянной температуре. С повышением температуры значение ионного произведения воды возрастает, так как при этом возрастает степень электролитической диссоциации воды и, соответственно, концентрации ионов Н+ и ОН-.
Исходя из значения  можно вычислить значение концентрации ионов водорода и ОН--групп в водном растворе. Так в чистой воде при температуре 25°С
можно вычислить значение концентрации ионов водорода и ОН--групп в водном растворе. Так в чистой воде при температуре 25°С
[Н+] = [ОН-] =  моль/л.
моль/л.
При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация ОН--ионов уменьшается (так как ионное произведение воды величина постоянная). При добавлении к воде щелочи наблюдается обратная картина.
Концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды.
В водных растворах различают 3 типа среды:
[Н+] = 10-7 моль/л — среда нейтральная;
[Н+] 10-7 моль/л — среда кислая,
[Н+] -7 моль/л — среда щелочная.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию ионов водорода выражают через водородный показатель.
Водородный показатель обозначают символом pH («пэ-аш»),
Понятие «водородный показатель» было введено датским химиком Серенсеном в 1909 г. Буква «р» — начальная буква датского слова potenz — математическая интересно степень, буква «Н» - символ водорода.
Водородным показателем (pH) называется десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
pH = -lg[H+], или [Н+] = 10-рн.
С помощью pH реакция растворов характеризуется так:
1) pH = 7 — среда нейтральная;
2) pH
3) pH 7 — среда щелочная.
Более наглядно зависимость между концентрацией ионов водорода [Н+], величиной pH и реакцией раствора можно выразить схемой:
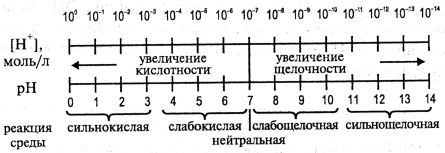
На схеме видно, что чем меньше pH, тем больше концентрация ионов Н+, т. е. выше кислотность среды. И наоборот: чем больше pH, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
Значение pH имеет большое значение в химических и биологических процессах, так как в зависимости от реакции среды эти процессы могут протекать с различными скоростями и в различных направлениях. Например, растения могут нормально произрастать лишь при значениях pH почвенного раствора, лежащих в определенном интервале, характерном для данного вида растений. Например, на почвах с водородным показателем pH = 5,0-5,5 ростки ячменя погибнут, в то время как картофель именно в этом интервале pH дает особенно богатый урожай.
Определение pH растворов очень важно в сельском хозяйстве, науке, технике, медицине.
Для качественного определения pH водных растворов используют индикаторы. Индикатор — вещество, способное изменять свою окраску в зависимости от концентрации ионов водорода или ОН--групп в растворе.
По своей природе индикаторы являются слабыми кислотами (кислотный индикатор Hind) или слабыми основаниями (основный индикатор IndOH). Молекулы индикатора и его ионы имеют различную окраску. Например, лакмус — кислотный индикатор. Его диссоциацию можно представить схемой:

Согласно принципу Ле Шателье, увеличение концентрации ионов Н+ смещает равновесие диссоциации лакмуса в сторону образования недиссоциированных молекул Hind, поэтому в кислой среде лакмус приобретает красный цвет. Уменьшение концентрации ионов водорода, что достигается введением ионов ОН- (образуется Н+ + ОН- → Н2О), смещает равновесие диссоциации индикатора в сторону образования ионов Ind-, поэтому в щелочной среде лакмус приобретает синюю окраску. В нейтральной среде молекулы Hind совместно с ионами Ind- придают раствору фиолетовую окраску.
Метиловый оранжевый (метилоранж) основный индикатор IndOH. Его диссоциацию можно представить схемой:
Увеличение концентрации ионов ОН- смещает равновесие диссоциации индикатора в сторону образования молекул IndOH (окраска желтая), повышение концентрации ионов Н+ — в сторону образования ионов Ind (окраска красная).
Каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений pH. Интервал значений pH, в пределах которого индикатор изменяет свою окраску, называют областью перехода.
| Индикатор | Окраска недиссоциированных молекул | Область перехода pH | Окраска анионов |
| метиловый оранжевый | красная | 3,1-4,4 | желтая |
| метиловый красный | красная | 4,4-6,2 | желтая |
| лакмус | красная | 5,0-8,0 | синяя |
| фенолфталеин | бесцветная | 8,0-10,0 | малиновая |
ГИДРОЛИЗ СОЛЕЙ
Водные растворы солей имеют разные значения рН, т. е. показывают различную реакцию среды — кислую, щелочную или нейтральную.
Например, водный раствор хлорида алюминия АlСl3 имеет кислую среду (рН 2СO3 — щелочную среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (рН = 7). Эти соли не содержат в своем составе ионов водорода Н+ или гидроксид-ионов ОН-, которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах многие соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Механизм гидролиза
Соли — это вещества с ионной химической связью.
Когда кристалл соли, например хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными. Но если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла. Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидратированные ионы (соединения ионов с молекулами растворителя). Каждый ион является источником электрического поля и оказывает поляризующее действие на соседние с ним частицы, т. е. на молекулы воды гидратных оболочек. Под поляризующим действием (поляризацией) подразумевают направленное смещение положительных и отрицательных электрических зарядов в атомах, атомных группах или молекулах под влиянием внешнего электрического поля. Таким образом, гидролиз солей можно рассматривать как результат поляризующего действия ионов на молекулы воды гидратной оболочкой. Вследствие поляризующего действия ионов молекулы воды не только деформируются, но и распадаются на составляющие ее частицы:
Термин «диссоциация» в данном случае не употребляют, так как диссоциация — процесс распада вещества на ионы под действием полярных молекул растворителя. В данном случае на ионы распадается сам растворитель. Далее происходит взаимодействие ионов соли с ионами, образующимися при распаде воды. В общем виде этот процесс можно представить следующим образом:
соль ↔ Katn+ + Апп-.
Реакция по катиону: Katn+ + НОН ↔ KatOH(n-1)+ + Н+- среда кислая, pH
Реакция по аниону: Апп- + НОН ↔ НАп(n-1)- + ОН- — среда щелочная, pH7.
Поляризующим действием практически не обладают катионы сильных оснований и анионы сильных кислот. Все остальные ионы обладают поляризующим действием.
Поляризующее действие иона будет тем больше, чем больше заряд и меньше радиус иона. Важную роль играет и тип электронной оболочки. При равном заряде и близком радиусе поляризующее действие катионов с 18-электронными и незаконченными оболочками (Zn2+ 1s22s22р63s23р63d10 или Mn2+ 1s22s22р63s23р6 3d5) и особенно наличие в оболочке нечетного числа электронов будет значительно больше, чем катионов с 8-электронным внешним слоем (Na+ 1s22s22р6).
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОH- или ионами водорода Н+ из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит).
Химическое равновесие процесса диссоциации воды смещается вправо:
Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h).
Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул:
 ,
,
где n — число молекул соли, подвергшихся гидролизу; N — общее число растворенных молекул соли.
Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, а также при повышении температуры степень гидролиза увеличивается.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой НСlO и сильным основанием NaOH.
В зависимости от силы исходного основания и кислоты, образующих соль, можно выделить четыре типа солей:
• соли, образованные слабым основанием и сильной кислотой (CuCl2, NH4Br, FeSO4, Mn(NO3)2);
• соли, образованные сильным основанием и слабой кислотой (NaCN, K2CO3, BaS);
• соли, образованные слабым основанием и слабой кислотой (CH3COONH4, (NH4)2S, Pb(NO2)2, Al2S3);
• соли, образованные сильным основанием и сильной кислотой (NaCl, K2SO4, Ca(NO3)2, BaI2, CsBr).
Сильные основания содержат катионы: Li+, Na+, К+, Rb+, Cs+, Ca2+, Sr2+, Ba2+, т. e. катионы щелочных и щелочноземельных металлов.
Сильные кислоты содержат анионы: Сl-, Вr-, I-, NO3-, СlO4-, MnO4-, SO42-.
Сила основания и сила кислоты, образующих соль, определяют тип гидролиза, характер продуктов гидролиза и pH среды получающегося раствора.
Гидролиз соли, образованной слабым основанием и сильной кислотой
Гидролиз этого типа солей называется гидролизом по катиону. Рассмотрим в качестве примера гидролиз хлорида аммония NH4Cl. В водном растворе данная соль подвергается полной диссоциации:
NH4Cl ↔ NH4+ + Сl-.
катион анион
слабого сильной
основания кислоты
Взаимодействовать с составными частями воды может только катион слабого основания или анион слабой кислоты.
С водой возможна реакция лишь того иона, который с одним из ионов воды, Н+ или ОН- дает слабый электролит. Взаимодействие иона Сl с водой невозможно, так как образовавшаяся при этом хлороводородная кислота НСl — сильный электролит. При гидролизе иона NH4+ получается слабый электролит — гидроксид аммония NH4+ОН. Значит возможен гидролиз по катиону.
Катион NH4+ как катион слабого основания взаимодействует с составными частями одной молекулы воды:
NH4+ + Н+ОН- ↔ NH4OH + Н+.
Из краткого ионно-молекулярного уравнения реакции видно, что катионы NH4+ связывают ионы ОН- из воды, образуя слабое основание. В растворе появляется избыток ионов водорода Н+, которые придают раствору соли кислый характер (pH
На основании краткого ионно-молекулярного уравнения реакции записываем молекулярное уравнение гидролиза:
NH4Cl + Н2O ↔ NH4OH+ НСl.
Гидролиз солей, в состав которых входят многозарядные ионы металлов, образующие слабые основания (Fe2+, Fe3+, Mg2+, Аl3+ и др.), протекает ступенчато и сопровождается образованием основной соли (точнее, гидроксокатиона).
Механизм гидролиза солей, в состав которых входят многозарядные ионы металлов, образующие слабые основания (Fe2+, Fe3+, Mg2+, Al3+ и др.) основан на том, что при диссоциации данных солей образуются гидратированные ионы, которые условно можно представить в виде аквакомплексов:
Следовательно, катионы в водном растворе существуют в виде катионных аквакомплексов, образованных за счет донорно-акцепторного взаимодействия Ме—ОН2 (ион металла проявляет свойства акцептора неподеленной электронной пары кислорода). Такой аквакомплекс катиона заключен в квадратные скобки. В свою очередь он взаимодействует с окружающими молекулами воды за счет водородной связи. В растворе устанавливается равновесие:
[Н2O Ме ОН2]n+ + Н2O ↔ [Н2ОМeОН2]n+ ... Н2O.
аквакомплекс
Если металл обладает большим поляризующим действием (малый радиус, большой заряд), то донорно-акцепторная связь, существующая между Ме—ОН2, превращается в ковалентную. При этом кислород в еще большей степени оттягивает на себя электроны от водорода, что влечет за собой еще большую поляризацию связи О—H в молекуле воды. Постепенно эта связь ослабляется, вплоть до отрыва иона H+, что можно представить схемой:
В растворе появляется избыток Н3O+, т. е. среда кислая. Сокращенно это записывается так:
Меn++ НОН ↔ Ме(n-1)+ + Н3O+.
В качестве примера рассмотрим гидролиз хлорида меди СuСl2(+2).
Уравнение диссоциации хлорида меди СuСl2 (+2) в водном растворе имеет вид:
CuCl2 ↔ Cu2+ + 2Сl-.
катион анион
слабого сильной
основания кислоты
Записываем краткое ионно-молекулярное уравнение первой ступени гидролиза:
Сu2+ + Н+ОН- ↔ СuОН+ + Н+.
гидроксо-катион меди
Ионы меди связывают гидроксид-ионы из воды, образуя гидроксокатион меди. В растворе наблюдается избыток ионов водорода, среда раствора кислая (pH
Составляем молекулярное уравнение
СuСl2 + Н2O ↔ CuOHCl + НСl.
хлорид гидроксомедь (+2)
(основная соль)
В результате первой ступени гидролиза хлорида меди (+2) в растворе накапливаются ионы Н+, которые, в соответствии с принципом Лe Шателье способствуют смещению химического равновесия влево, т. е. подавляют гидролиз по второй ступени.
В обычных условиях гидролиз практически протекает по первой ступени. Гидролиз по второй и последующим ступеням идет в ничтожно малой степени.
Гидролиз по второй ступени следует учитывать лишь при сильном разбавлении и нагревании. В этом случае краткое ионно-молекулярное уравнение второй ступени гидролиза имеет вид: CuOH+ + Н+ОН- ↔ Сu(ОН)2 + Н+.
Молекулярное уравнение: CuOHCl + Н2O ↔ Cu(OH)2 + НСl.
Продуктом второй ступени гидролиза хлорида меди (+2) являются гидроксид меди и соляная кислота. В результате протекания гидролиза по второй ступени раствор соли приобретает более кислый характер, потому что в растворе увеличивается концентрация гидроксид-ионов.
Гидролиз соли, образованной сильным основанием и слабой кислотой
Гидролиз солей данного типа называется гидролизом по аниону.
Рассмотрим гидролиз ацетата натрия CH3COONa. Эта соль в воде находится в состоянии полной диссоциации:
CH3COONa ↔ СН3СОO-+ Na+.
анион катион
слабой сильного
кислоты основания
Записываем краткое ионно-молекулярное уравнение гидролиза:
СН3СОO- + Н+ОН- ↔ СН3СООН + ОН-.
Из уравнения следует: ионы СН3СОO- связывают ионы Н+ из воды, образуя слабую кислоту. В растворе появляется избыток гидроксид-ионов, которые придают раствору соли щелочной характер (pH7).
Записываем молекулярное уравнение гидролиза:
CH3COONa + Н2O ↔ СН3СООН + NaOH.
Гидролиз солей, в состав которых входят анионы слабых многоосновных кислот, протекает ступенчато и сопровождается образованием кислой соли (точнее, кислого аниона).
Механизм гидролиза солей, в состав которых входят анионы слабых многоосновных кислот, также связан с образованием в их растворах анионных аквакомплексов:
В анионных аквакомплексах ионы образуют с молекулами воды водородные связи Аn- ... НОН. При достаточно сильном взаимодействии анион способен отрывать протон Н+, превращая водородную связь в ковалентную по донорно-акцепторному механизму (причем анион выступает в качестве донора неподеленной электронной пары) и высвобождая гидроксид-ионы:
[ОН2 ... А... НОН] → [ОН2 .... А‒Н](n-1)- + ОH-.
В сокращенном виде это записывается так: Аn- + НОН ↔ НА(n-1)- + ОН-.
В качестве примера рассмотрим гидролиз карбоната натрия Na2CO3. Эта соль в воде находится в состоянии полной диссоциации.
Na2CO3 ↔ 2Na+ + СO32-.
катион анион
сильного слабой
основания кислоты
Записываем краткое ионно-молекулярное уравнение гидролиза:
СO32- + Н+ОН- ↔ НСО3- + ОН-.
Анионы СO32- связывают ионы Н+ из воды, образуя кислые анионы НСO3-. В растворе накапливаются гидроксид-анионы, среда раствора становится щелочной (pH7). Составляем молекулярное уравнение:
Na2CO3 + Н2O ↔ NaHCO3 + NaOH.
гидрокарбонат
натрия (кислая соль)
Гидролиз идет преимущественно по первой ступени.
Гидроксид-ионы, образующиеся на первой ступени в соответствии с принципом Ле Шателье, смещают химическое равновесие влево, т. е. подавляют гидролиз по второй ступени.
Гидролиз соли, образованной слабым основанием и слабой кислотой
Гидролиз солей данного типа называется гидролизом по катиону и по аниону.
Рассмотрим гидролиз ацетата аммония:
CH3COONH4 ↔ СН3СОО- + NH4+.
Записываем краткое ионно-молекулярное уравнение гидролиза:
Ионы NH4+ связывают гидроксид-ионы из воды, образуя слабое основание. Ионы СН3СОО- связывают ионы водорода, образуя слабую кислоту.
Составляем молекулярное уравнение:
CH3COONH4 + H2O ↔ СН3СООН + NH4OH.
Гидролиз солей, образованных слабой кислотой и слабым основанием, протекает особенно глубоко и является необратимым.
Причина того, что гидролиз солей, образованных слабым основанием и слабой кислотой, протекает сильнее по сравнению с другими случаями гидролиза, заключается в следующем. При гидролизе слабого катиона образуются ионы Н+:
NH4+ + Н+ОН- ↔ NH4OH + Н+.
При гидролизе слабого аниона образуются ионы ОН-:
СН3СОО- + Н+ОН- ↔ CH3COOH + ОН-.
Ионы Н+ и ОН- не могут в значительных концентрациях одновременно существовать в растворе. Они соединяются, образуя молекулы воды. Это приводит к смещению обоих равновесий вправо. То есть гидролиз катиона и гидролиз аниона в этом случае усиливают друг друга.
Реакция раствора солей, образованных слабым основанием и слабой кислотой, зависит от соотношения констант диссоциации соответствующего основания и кислоты.
В случае, если KД(кисл) KД(осн), среда раствора слабокислая.
В случае, если KД(осн) KД(кисл), среда раствора слабощелочная.
В случае гидролиза ацетата аммония среда раствора нейтральная (pH7):
KД(СН3СООН) ≈ KД(NH4OH) ≈ 1,8*10-5.
Гидролиз соли, образованной сильным основанием и сильной кислотой
В составе соли, образованной сильным основанием и сильной кислотой (например, NaCl, ВаСl2, Na2SO4, KNO3), нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит. Поэтому соли данного типа гидролизу не подвергаются. Растворы таких солей имеют нейтральную среду (pH = 7).







 .
. .
. .
. .
.
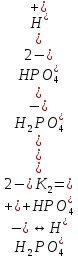

 .
.


 .
. .
. 1,8*10-16 (при 25°С).
1,8*10-16 (при 25°С). .
. , получим:
, получим:  моль/л.
моль/л.











