Тема «Металлы»
Урок «Обобщение по теме «Металлы»
Цель: обобщить и систематизировать знания учащихся о металлах и их соединениях.
Задачи:
Опираясь на знания учащихся, добиться понимания ими понятий «металлы – химические элементы», «металлы – простые вещества».
Закрепить знания учащихся о физических и химических свойствах металлов, об основных областях их применения.
Продолжить обогащение словарного запаса, развитие творческих способностей, умения выделять главное, сравнивать, обобщать.
Привить навыки использования теоретических знаний для решения практических вопросов.
Тип урока: обобщение и систематизация учебного материала.
Класс: 9
Основные вопросы:
Общая характеристика элементов-металлов по положению в периодической системе Д.И.Менделеева.
Распространение и роль элементов-металлов в природе.
Простые вещества-металлы, их физико-химические свойства и способы получения.
Важнейшие соединения металлов, их свойства и роль в жизни человека.
Основные понятия: восстановители, щелочные металлы, щелочноземельные металлы, металлургия, алюминотермия, пассивирование.
Планируемые результаты:
Усвоение системы знаний о химических элементах-металлах, в том числе особенностей строения их атомов.
Развитие и обобщение знаний учащихся о нахождении и роли металлов в природе.
Обобщение знаний о физико-химических свойствах металлов как простых веществ.
Развитие и обобщение знаний учащихся о практическом использовании металлов, их сплавов.
Развитие научного мировоззрения школьников при усвоении ведущих мировоззренческих идей курса: единство и познаваемость мира; единство живой и неживой природы; зависимость свойств вещества от особенностей его состава и строения; получение и применение вещества в зависимости от его состава, свойств, нахождения и роли в природе.
Развитие мотивации изучения предмета при обращении к жизненному опыту школьников, при раскрытии практического значения материала с последующим его экспериментальным подтверждением.
Реактивы и оборудование: медная проволока, гранулы цинка, р-р нитрата серебра, р-р сульфата меди, железные гвозди, изделия из алюминия, оксид меди(II), магний, соляная кислота
прибор для получения газов, штатив, пробирки, жел. ложечка, стаканы.
Структура урока
Организационный момент.
I. Мотивация. Актуализация знаний.
Где бы вы ни были: в школе, в отряде, на улице – видно, какое множество металлов трудится вокруг нас и для нас. Без металлов не обходится ни автослесарь, ни повар-пекарь, ни мастер сухого строительства. Всего не перечесть, ведь нас окружают десятки металлов. Тема урока…
Исходя из темы, надо определить цель урока. Подумайте и скажите, какие знания о металлах мы будем сегодня обобщать? Знания о металлах, их свойствах, областях применения нам и надо сегодня обобщить на уроке.
По какому плану мы будем работать? II. Составление плана работы (предлагается подумать, с какого вопроса логичнее начать разговор о металлах, и привести аргументы в подтверждение своей правоты. В результате беседы выстраивается план урока).
Описание элемента по плану характеристики химического элемента.
( план характеристики на индивидуальных карточках)
Нахождение и роль элемента в природе (анализ диаграмм)
Получение
Физические свойства (вопросы, диаграммы)
Химические свойства (составление уравнений реакций)
Применение (рассказ учителя)
Ваша задача – продемонстрировать максимальный уровень знаний по теме «Металлы». В ходе урока вы заработаете оценки за устные ответы, письменные задания, должны дополнять, задавать вопросы. Надеюсь, вы будете внимательно меня слушать и мы добьемся цели, которую поставили. В качестве разминки каждый из вас называет любой металл, но чтобы не было повторений. III. Обобщение материала.
Строение атомов металлов.
Задание. Заполнить таблицу по вариантам.
У атомов натрия и магния одинаковое число
нейтронов в ядре атома
протонов в ядре атома
внешних электронов
электронов в атоме
Для выбора правильного ответа нам необходимо, используя метод сравнения, выявить сходство в составе и строении атомов натрия и магния. Такое сравнение удобно представить в форме таблицы:
| Признаки сравнения | Na | Mg |
| Порядковый номер | 11 | 12 |
| Заряд ядра | +11 | +12 |
| Число протонов в ядре | 11 | 12 |
| Общее число электронов в атоме | 11 | 12 |
| Число внешних электронов!!!! | 1 | 2 |
| Атомная масса | 23 | 24 |
| Число нейтронов в ядре | 12 | 12 |
После такого сравнения правильный ответ очевиден. Кроме этого можно отметить и различие сравниваемых объектов.
Но одна особенность общая как для всех металлов. Какая?
Выводы: в атомах металлов находится 1-3 внешних электронов. Они их отдают, проявляя восстановительные свойства.
Нахождение и роль элемента в природе (анализ диаграмм).
В каком виде металлы встречаются в природе?
Металлы находятся в природе как в свободном виде – самородные металлы, так и в виде соединений.
Назовите самородные металлы и почему их называют благородными?
Платина, золото, серебро, реже медь…не окисляются кислородом.
Почему металлы встречаются в основном в виде соединений?
Из-за своей высокой химической активности большинство металлов существует в виде минералов. Минералы входят в состав горных пород и руд.
Какие места по распространенности в земной коре занимают металлы? (работа с диаграммой)
Выводы: Металлы находятся в природе как в свободном виде, так и в виде соединений. По распространенности в земной коре алюминий занимает первое место среди металлов и третье - среди всех элементов. Железо – второй среди металлов и четвертый после кислорода, кремния и алюминия.
Запасы железных руд Северного района оцениваются в более чем 3 млрд. тонн и составляют около 5% запасов Российской Федерации. Наиболее крупными месторождениями железной руды являются Костомукшское (Республика Карелия), Ковдорское и Оленегорское (Кольский полуостров).
Наиболее крупное месторождение титановых руд – Ярегское месторождение на территории Республики Коми, является одним из крупнейших в России. Разведано новое месторождение титана на реке Ухте, имеющее благоприятные горно-геологические условия для открытой добычи. Титаносодержащее сырье обнаружено также в Мурманской области, в этом же регионе расположены месторождения медно-никелевых руд.
В Карелии имеются месторождения мрамора и гранита. Из других сырьевых ресурсов можно выделить высококачественную слюду, известняки, кирпичные и огнеупорные глины, кварцевые пески, доломиты, полевой шпат, апатиты, поваренную соль.
Черная и цветная металлургия
Черная металлургия занимает около 20% экономики Северного района и специализируется на добыче железной руды, выплавке чугуна и стали, производстве проката. Важнейшими являются Костомукшское месторождение в Карелии, открытое в 1946 году (Костомукшский ГОК), Оленегорское месторождение в Мурманской области, открытое в 1949 году (Оленегорский ГОК). На базе Ковдорского и Оленегорского месторождений действует Череповецкий металлургический завод.
Цветная металлургия и, в первую очередь медно-никелевая промышленность, представлена в районе объединением «Никель» (город Мончегорск Мурманской области), использующим в основном ресурсы Северного района. На территории Архангельской области находятся крупнейшие месторождения бокситов – Североонежский бокситоносный район, включающий в себя Иксинское месторождение, открытое в 1949 году.
Получение металлов.
Опыт «Восстановление меди водородом из оксида меди(II)».
Водород – хороший восстановитель.
Получаем водород взаимодействием цинка и соляной кислоты.
Направим водород в пробирку с оксидом меди.
Реакция восстановления меди идет при нагревании.
Водород связывает кислород, образуя воду, выделятся свободная медь.
Уравнение реакции:__________________________
Почему добыча металлов так важна?
Найдите здесь как можно больше изделий из металлов. Как вы догадались, что они из металлов? У них особые физические свойства.
Физические свойства металлов.
Железная ложка – тепло передается.
Где используется это свойство? Изготовление посуды.
Проволока гнется, деревянная палочка ломается.
Где используется это свойство? Изготовление орудий труда. Благодаря орудиям труда человек стал царем природы.
Чем определяются общие физические свойства металлов?
Строением, металлическая связь, наличие подвижных электронов.
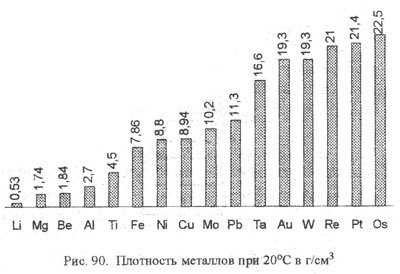
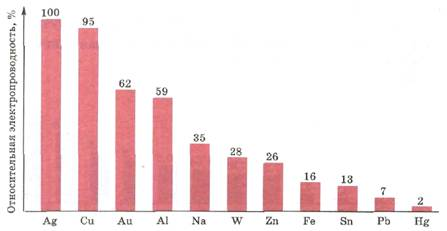
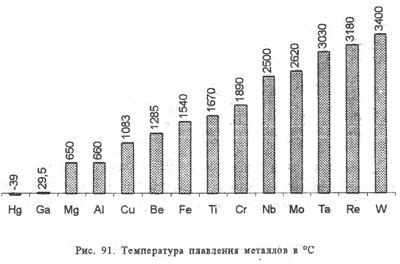
Работа с диаграммами по парам. Выявить самых-самых..
По физическим свойствам металлы сильно отличаются друг от друга:
Литий легче воды в 2 раза,
Осмий тяжелее воды в 2 раза.
Цезий плавится на ладони,
Вольфраму нужна температура, только в 2 раза меньше температуры на солнце.
Натрий, калий режутся ножом
Хром с трудом поддается механической обработке.
Несмотря на всё разнообразие, эти элементы образуют единую семью.
Химические свойства металлов. Самые активные?
Железный гвоздь + сульфат меди→ медь + сульфат железа
Медь + нитрат серебра → нитрат меди + серебро
Горение бенгальских огней
Бенгальский огонь — горючий состав, используемый в пиротехнике. Современный искристый бенгальский огонь содержит азотнокислый барий в качестве окислителя, порошок алюминия или магния как горючее, декстрин или крахмал в качестве клея, а также оксидированные железные или стальные опилки для образования искр.
Бенгальские свечи состоят из кусков железной проволоки с бенгальским огнём, нанесённым на один из концов.
Вопрос по Анне Ахматовой.
Медь химически малоактивна, в атмосфере, содержащей углекислый газ, пары воды и др. покрывается патиной – зеленоватой пленкой.
Применение металлов.
В таблице Менделеева трудно найти какой-либо иной элемент, с которым так неразрывно связалась бы жизнь всего человечества. Нет другого элемента, при участии которого проливалось бы так много крови, терялось бы столько жизней, происходило бы столько несчастий. Как сказал А. Блок:
Век девятнадцатый железный,
Воистину железный век,
Почему век железный?
Железо – основа всей современной цивилизации.
Почему в технике используют преимущественно сплавы, а не чистые металлы?
Чистые металлы не обладают всеми свойствами, необходимыми для применения.
Сплавы на основе железа:
Основной материал современной техники – сталь.
Она применяется в машиностроении, химической, горной промышленности. В быту - бытовая техника, посуда, инструменты.
Сплавы на основе меди: бронза и латунь.
С/Р «Применение металлов».
Вспомним цель урока. Подведем итог урока. Достигли мы поставленных целей? Выставление отметок.
Задание. Заполнить таблицу по вариантам. Выявить сходство в составе и строении атомов натрия и магния.
| Признаки сравнения | Na | Mg |
| Порядковый номер |
|
|
| Заряд ядра | +11 | +12 |
| Число протонов в ядре |
|
|
| Общее число электронов в атоме |
|
|
| Число внешних электронов! |
|
|
| Атомная масса |
|
|
| Число нейтронов в ядре |
|
|
Задание. Заполнить таблицу по вариантам. Выявить сходство в составе и строении атомов натрия и магния.
| Признаки сравнения | Na | Mg |
| Порядковый номер |
|
|
| Заряд ядра | +11 | +12 |
| Число протонов в ядре |
|
|
| Общее число электронов в атоме |
|
|
| Число внешних электронов! |
|
|
| Атомная масса |
|
|
| Число нейтронов в ядре |
|
|
Задание. Заполнить таблицу по вариантам. Выявить сходство в составе и строении атомов натрия и магния.
| Признаки сравнения | Na | Mg |
| Порядковый номер |
|
|
| Заряд ядра | +11 | +12 |
| Число протонов в ядре |
|
|
| Общее число электронов в атоме |
|
|
| Число внешних электронов! |
|
|
| Атомная масса |
|
|
| Число нейтронов в ядре |
|
|
Выражения с использованием названий металлов
Золото не говорит – да много творит
Золотой ключик все двери открывает
Золотые ручки не испортят мучки
Родина краше солнца, краше золота
Сибирь – золотое дно
Воля лучше золотой клетки
Не нужна соловью золотая клетка, а нужна зеленая ветка.
Золотой был человек – мухи не обидел
Сказанное слово серебряное, не сказанное – золотое.
10



















