9 класс
Задание 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1 2 3
Сa → СaO → Сa(OH)2 → СaCI2
К уравнению реакции 1 составьте схему электронного баланса. Укажите окислитель и восстановитель.
Уравнение реакции 3 напишите в молекулярном, полном и сокращённом ионном виде.
Задание 2
Решите задачу:
Какая масса осадка образуется при взаимодействии избытка раствора нитрата бария Ba(NO3)2 c 196 г раствора серной кислоты с массовой долей растворённого вещества 5%?
Задание 3
В лаборатории имеются железо, соляная кислота, едкий натр, карбонат кальция, оксид меди (II). Используя эти вещества, а также продукты их взаимодействия, приведите не менее 10 уравнений реакций получения новых неорганических веществ.
Задание 4
Используя метод электронного баланса, составьте уравнение реакции:
KNO +КI+ H
+КI+ H SO
SO
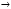 I
I + NO + К
+ NO + К SO
SO + H
+ H О
О
Определите окислитель и восстановитель.
Задание 5
Составьте уравнения реакций, соответствующие описаниям превращений:
Основный оксид+ кислотный оксид = соль
Кислотный оксид + соль = соль + кислотный оксид
Простое вещество+ соль = соль + простое вещество
Соль + основание = основание + соль
Простое вещество + кислотный оксид = кислотный оксид
Кислота + кислотный оксид = кислотный оксид + кислота
Задание 6
Мысленный эксперимент.
В четырех пронумерованных пробирках находятся растворы следующих веществ: хлорида натрия, азотной кислоты, нитрата серебра, фосфата калия. Определите содержимое каждой из пробирок, не пользуясь никакими другими реактивами. Составьте уравнения реакций, выразите сущность этих реакций.
КРИТЕРИИ ОЦЕНИВАНИЯ
9 класс
Задание 1.
Написаны уравнения реакций, соответствующие схеме превращений:
1) 2Сa + O2 → 2СaO 1 балл
2) СaO + H2O → Сa(OH)2 1 балл
3) Сa(OH)2 + 2HCI → СaCI2 + 2H2O 1 балл
К уравнению 1 составлена схема электронного баланса: 1 балл
![]() 0 2+
0 2+
Сa – 2e → Сa 2
0 2-
O2 + 4e → 2O 1
0
Вa – восстановитель
0
O2 - окислитель
Уравнение 3 написано в молекулярном, полном и сокращённом ионном виде. 1 балл
2+ - + - 2+ -
Ba + 2OH + 2H + 2CI → Ba + 2CI + 2H2O
+ -
H + OH → H2O
Итого: 5 баллов
Задание 2.
1) Составлено уравнение реакции: 1 балл
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
2) Рассчитана масса и количество вещества серной кислоты, содержащейся в растворе. 1 балл
m (H2SO4) = m р-ра •w/100 = 196 • 0, 05 = 9,8 (г)
n (H2SO4) = m (H2SO4) / M (H2SO4) = 9,8 : 98 = 0,1 (моль)
3) Определена масса вещества, выпавшего в осадок: (1 балл)
по уравнению реакции: n (H2SO4) = n (BaSO4) = 0,1 (моль)
m (Ba2SO4) = n (Ba2SO4) • M (BaSO4) = 0,1 • 233 = 23,3 (г) 1 балл
Итого: 3 балла
Задание 3.
Возможные варианты ответа:
Fe + 2HCl = FeCl2 + H2
HCl + NaOH = NaCl + H2O
2HCl + CaCO3 = CaCl2 + H2O + CO2
CuO + 2HCl = CuCl2 + H2O
2NaOH + CO2 = Na2CO3 + H2O; NaOH + CO2 = NaНCO3
CuO + H2 = Cu + H2O
FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl
3Fe + 4H2O = Fe3O4 + 4H2
CaCO3 = CaO + CO2
CuO + CO2 = CuCO3
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O и т.д.
При оценивании задания рекомендуется принимать и другие возможные верно составленные уравнения. За каждое верное написанное уравнение реакции по 1 баллу.
Итого: 9 баллов
Задание 4.
Составлен электронный баланс: 1 балл
N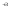 + 1e
+ 1e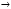 N
N
2I - 2e
- 2e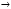 I
I
Расставлены коэффициенты в уравнении реакции. 1 балл
2 KNO + 2 KI + 2 H
+ 2 KI + 2 H SO
SO = I
= I + 2NO + 2 K
+ 2NO + 2 K SO
SO + 2 H
+ 2 H O
O
Правильно определены окислитель и восстановитель. 1 балл
Итого: 3 балла
Задание 5.
CaO + CO = CaCO
= CaCO
SiO + CaCO
+ CaCO = CaSiO
= CaSiO + CO
+ CO
CL + 2NaBr = 2 NaCL + Br
+ 2NaBr = 2 NaCL + Br или Fe + CuSO
или Fe + CuSO = FeSO
= FeSO + Cu
+ Cu
CuCl + 2 NaOH = Cu(OH)
+ 2 NaOH = Cu(OH) + 2NaCl или Ca(OH)
+ 2NaCl или Ca(OH) + Na
+ Na CO
CO = CaCO
= CaCO + 2NaOH
+ 2NaOH
O + 2 SO
+ 2 SO = 2 SO
= 2 SO
6 HNO + P
+ P O
O =3 N
=3 N O
O + 2 H
+ 2 H PO
PO
Максимально 6 баллов
Задание 6.
Составим таблицу возможных взаимодействий веществ попарно:
|
| NaCl | HNO | AgNO | K PO PO |
| NaCl | - | Без изменений | Осадок белого цвета | Без изменений |
| HNO | Без изменений | - | Без изменений | Без изменений |
| AgNO | Осадок белого цвета | Без изменений | - | Осадок желтого цвета |
| K PO PO | Без изменений | Без изменений | Осадок желтого цвета | - |
Уравнения реакций:
NaCl + AgNO = AgCl + NaNO
= AgCl + NaNO
K PO
PO + 3 AgNO
+ 3 AgNO = Ag
= Ag PO
PO + 3 KNO
+ 3 KNO
По 1 баллу за каждое определенное вещество (4 балла); 2 балла за написание уравнений химических реакций; 2 балла за написание сущности двух реакций.
Итого: 8 баллов
10 класс
1. Учащимися в процессе исследования свойств раствора выданной соли было проведено два опыта. При проведении первого опыта к раствору соли добавили гидроксид калия и нагрели на спиртовке, в результате чего выделился газ с раздражающим запахом. А ко второй части раствора соли прилили раствор нитрата свинца, в результате чего образовался чёрный осадок.
Запишите химическую формулу и название выданной соли. Составьте два молекулярных уравнения реакции, соответствующих опытам, проведённым учащимися в процессе исследования соли.
2. Расставьте коэффициенты методом электронного баланса
Cu + HNO → Cu(NO
→ Cu(NO )
) +NO
+NO +H
+H O
O
Укажите окислитель и восстановитель.
3. Составьте все возможные изомеры вещества С Н
Н . Назовите эти вещества.
. Назовите эти вещества.
4. Относительная плотность паров органического соединения по водороду равна 42. При сжигании 7 г этого вещества образуется 22 г углекислого газа и 9 г воды. Выведите молекулярную формулу органического соединения. Составьте структурную формулу вещества. Напишите уравнения реакции горения этого вещества.
5. В сосуде находится смесь метана и ацетилена. Объем кислорода, необходимый для полного сгорания этой смеси, в 2,25 раза больше объема исходной смеси. Рассчитайте состав смеси в объемных процентах.
КРИТЕРИИ ОЦЕНИВАНИЯ (10 класс)
Задание 1. Записаны химическая формула и название выданной соли:
(NH )
) S - сульфид аммония 1 балл
S - сульфид аммония 1 балл
Составлены два уравнения реакции:
1) (NH )
) S + 2КОН = К
S + 2КОН = К S + 2NН
S + 2NН + 2Н
+ 2Н 0 1 балл
0 1 балл
2) (NH )S + Рb(N0
)S + Рb(N0 )
) = 2NН
= 2NН N0
N0 + РbS | 1балл
+ РbS | 1балл
Итого:3 балла
Задание 2.
За уравнение с коэффициентами 1 балл
За правильно составленный электронный баланс 1 балл
За окислитель и восстановитель 1 балл
Итого:3 балла
Задание 3.
За каждый правильный изомер с названием по 1 баллу, без названия 0,5 балла.
Максимально 3 балла
Задание 4.
n(C) = 0.5 моль п(Н) = 1 моль наличие кислорода m(0)=0
простейшая формула 1:2 истинная формула С Н
Н
Определена простейшая формула вещества 1 балл
Определена молекулярная формула вещества (истинная) 1 балл
Составлена структурная формула вещества 1 балл
Составлено правильно уравнение реакции горения вещества 1 балл
Итого: 4 баллов
Задание 5. Задачу можно решать любым способом.
Составлены уравнения реакций горения метана и ацетилена 1 балл
Определены объемы кислорода для сжигания этих газов: V(О )
) = 2х л
= 2х л
V(О )
) = 2,5 (1-х) л 1 балл
= 2,5 (1-х) л 1 балл
Найден объем кислорода, необходимый для сжигания 1 л смеси
V(О )
) =2х+2,5(1-х) 1 балл
=2х+2,5(1-х) 1 балл
Выполнены все вычисления и найден правильный ответ: 50% (по объему) метана и 50% (по объему) ацетилена. 2 балла
Итого: 5 балла
Максимальное количество баллов за работу: 18 баллов, призеры с 9 баллов
11 класс
1. Используя карбонат кальция, соляную кислоту, гидроксид натрия и воду,
получить не менее шести сложных веществ, не применяя электролиз. Приведите
уравнения соответствующих реакций. (5 баллов)
2. Вычислить массовую долю серной кислоты в растворе, в котором числа
атомов водорода и кислорода равны между собой. Какой объем 30%-ного
раствора, имеющего плотность 1,22г/мл, можно приготовить из 100 г этого
раствора? (5 баллов)
3. Через 500 г 5,6%-ного раствора гидроксида калия пропустили 8,4 л
сероводорода (объем измерен при нормальных условиях). Вычислить
концентрации (в %) веществ в полученном растворе. (5 баллов)
4. Содержание брома в соединении, полученном при взаимодействии алкена с
бромом, составляет 69,56% по массе. Определить структурную формулу алкена,
если известно, что он может существовать в виде цис-и транс-изомеров.(3 балла)
5. 1,124 г бромопроизводного пропана гидролизовали водным раствором
щелочи. К полученному после гидролиза раствору добавили избыток водного
раствора нитрата серебра и получили 2,256 г осадка. Определить возможное
строение бромопроизводного. (5 баллов)
Решения олимпиадных заданий школьного тура о химии
11 класс
1. Формулы исходных веществ: СаСО3, HCl, NaOH, H2O.
Возможные взаимодействия: CaCO3 → CaO + CO2; CaO + H2O → Ca(OH)2;
CaCO3 + 2HCl→CaCl2 + H2O + CO2; NaOH + CO2→ NaHCO3;
NaOH + NaHCO3→Na2CO3 + H2O
NaOH + HCl → NaCl + H2O; CaCO3 + CO2 + H2O→ Ca(HCO3)2. Возможны
другие варианты взаимодействий. За каждое правильное взаимодействие,
приводящее к получению нового вещества по 0,5 балла. Формулы и названия
новых веществ 1 балл. Всего 5 баллов.
2. По условию ν(Н)=ν(О). Пусть масса раствора 100 г, в котором Х моль
H2SO4 и Yмоль Н2О.
Тогда 98х + 18y = 100 y = 2x x=0,75 = m(H2SO4)= 0,75∙98=73,1(г)
2x + 2y = 4x +y 134x = 100 y=1,5 ώ(H2SO4)=73,1%
В новом 30%-ном растворе масса серной кислоты 73,1 г = m(р-ра)2= 73,1/0,3=
243,7г=V(р-ра)=243,7/1,22=200мл. Всего 5 баллов.
3. Рассчитать количества веществ по условию задачи:
m(KOH)=500∙0,056=28г, ν(КОН)=0,5моль; ν(H2S)=8,4/22,4=0,375моль 1 балл
Уравнения возможных реакций:KOH +H2S =KHS +H2O;KHS + KOH = K2S + H2O
2 балла
Сероводород реагирует полностью, получается 0,375 моль KHS, при этом
используется 0,375 моль КОН, значит, во втором уравнении реагирует остаток
КОН 0,125 моль, образуется 0,125моль K2S, остается 0,25 моль KHS. Т.о. в
растворе находятся 0,125 моль K2S и 0,25 моль KHS 1 балл
Масса раствора складывается из масс исходных компонентов: m(р-ра)=500 +
0,375∙34= 512,75 г
ώ(KHS)=0,25∙72/512,75=0,035 или 3,5% ώ(K2S)=0,125∙110/512,75=0,0268
или2,68% 1 балл
Всего 5 баллов.
4. Уравнение реакции: CnH2n + Br2 → CnH2nBr2 1 балл
Нахождение молярной массы и формулы: М(СnH2nBr2)= 160/0,6956=230 г/моль
14n+160=230, 14n=70, n=5, значит, молекулярная формула алкена С5Н10 – это
пентен. 1 балл
По условию вещество имеет цис- и транс- изомеры, следовательно, двойная
связь находится не с краю. Структурная формула: СН3 – СН = СН - СН2 - СН3
пентен-2 1 балл
Всего 3 балла.
5. Так как не известно, сколько атомов водорода замещено в
бромопроизводном пропана на бром, вводим формулу C3H8-xBrx 1 балл
Уравнения реакций: C3H8-xBrx + xNaOH → C3H8-x(OH)x + xNaBr 1 балл
NaBr + AgNO3 = AgBr ↓+ NaNO3 1 балл
ν(AgBr)= 2,256/188=0,012 моль = ν(NaBr)=0,012 моль; ν(C3H8-xBrx)= 1,124/
(44+79x)= 0,012/x, отсюда 1,124х=0,528+0,948х; 0,176х=0,528; х=3. Формула
исходного вещества С3Н5Br3 1 балл
Возможное строение 1,2,2-трибромпропан. 1 балл
Всего 5 баллов.__





 +КI+ H
+КI+ H
 I
I + 1e
+ 1e
 - 2e
- 2e










