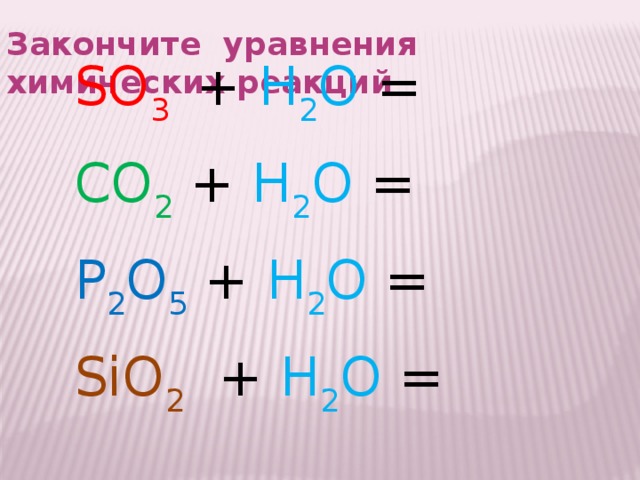Просмотр содержимого документа
«Презентация "Кислоты"»

Класс неорганических соединений
кислоты
Автор: Колесникова Н.А., учитель химии, биологии
МБОУ «СОШ п.Дебин»

Цели урока. 1 ) сформировать понятие о кислотах как электролитах; 2) рассмотреть классификацию кислот по различным признакам; 3) познакомить практически с химическими свойствами кислот в свете теории электролитической диссоциации; 4) развивать умения и навыки работы с химическими реактивами и химическим оборудованием; 5) учить сравнивать, анализировать, делать выводы; 6) совершенствовать умения и навыки в написании формул веществ и уравнений химических реакций.
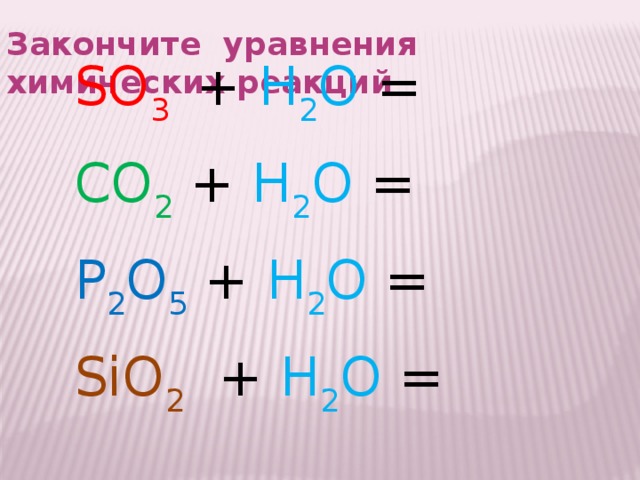
Закончите уравнения химических реакций
SO 3 + H 2 O =
CO 2 + H 2 O =
P 2 O 5 + H 2 O =
SiO 2 + H 2 O =

Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка
I II
H 2 SO 4
I I
H NO 3
I III
H 3 PO 4
I I
H Cl
ОПРЕДЕЛИТЕ КИСЛОТНЫЙ ОСТАТОК И ЕГО ВАЛЕНТНОСТЬ
H 2 SiO 3
H 2 CO 3
H 2 S
HBr
H NO 2

Выберите кислоты:
HCI CO 2 NaOH H 2 SO 4
NaCI H 3 PO 4 HNO 3 H 2 S
СаО H 2 CO 3 Н 2 О Н 2 SiO 4

Классификация кислот
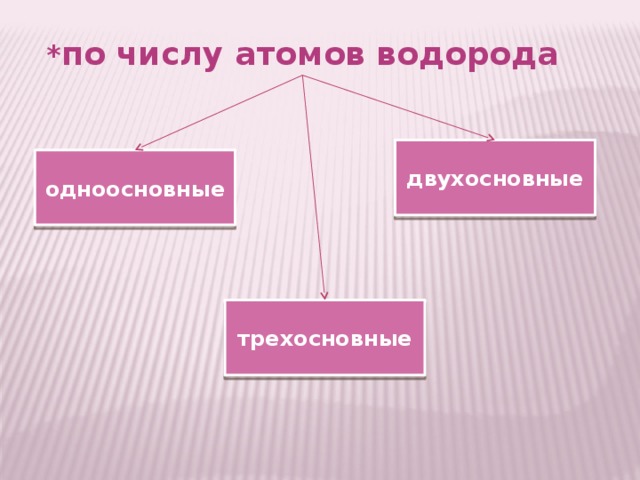
* по числу атомов водорода
двухосновные
одноосновные
трехосновные

* по cодержанию кислорода
бескислородные
кислородные
*по растворимости
нерастворимые
растворимые

Химические свойства
Ме
Основный оксид
Кислота +
Основание
Амфотерный оксид
Соль

Вариант I Вариант II
1.Даны вещества :
CaO; Al(OH) 3 ; HCl; KOH; Na 2 SO 4 ; MgO; Ba(OH) 2 ; H 2 SO 4 ; N 2 O 5 ; NaOH; HNO 3 ; Cu(OH) 2 ; HBr; H 2 S ; MgCO 3 ; Fe(OH) 3
Выбрать кислородные кислоты Выбрать бескислородные кислоты
2.Выбрать оксиды, с которыми реагирует
H 2 S HNO 3
а) SO 2 ; CO 2 а) Na 2 O; CaO
б) Al 2 O 3 ; MgO б) CO 2 ; N 2 O 5
в) N 2 O 5 ; P 2 O 5 в) FeO; K 2 O
г) CaO; Fe 2 O 3 . г) P 2 O 5 ; SO 3.
3. Выбрать вещества, с которыми реагирует
HCl ; HBr ;
а) CO 2 а) H 3 PO 4
б) СuO б) Na 2 O
в) H 2 SO 4 . в) CO.

Д/задание §34
Спасибо за работу