
Пискалова Т. И.

Урок №1
Цель урока для обучающихся : познакомиться с оксидами азота, их свойствами и применением; рассмотреть свойства разбавленной азотной кислоты как электролита.

Воспроизводство опорных знаний.
- Какие степени окисления проявляет азот в соединениях с кислородом?
- Запишите формулы возможных оксидов азота.
- Что означает понятие «несолеобразующий оксид»?
- Какие оксиды азота являются несолеобразующими?
- Какие оксиды азота относятся к кислотным?
Задание . Проверьте правильность ответов, используя слайд презентации.
Зафиксируйте в тетради новую для себя информацию.

Оксиды азота
+ 1 N 2 O
+ 2 NO
+ 3 N 2 O 3
+ 4 NO 2
+ 5 N 2 O 5
Несолеобразующие оксиды
Солеобразующие оксиды

Свойства оксидов.
Задание . Изучите свойства оксидов. Зафиксируйте новую для себя информацию.
N 2 O Бесцветный газ со слабым запахом и сладковатым вкусом, растворим в воде.
NO Бесцветный газ, без запаха. Малорастворим в воде. Быстро окисляется на воздухе. Ядовит !
N 2 O 3 Темно-синяя жидкость, хорошо растворимая в воде. Соединение непрочное.
NO 2 Газ бурого цвета, со специфическим
запахом. Хорошо растворим в воде. Я довит !
N 2 O 5 Белое кристаллическое вещество. Растворяется в воде с образованием азотной кислоты.

Кислотные оксиды
Оксид азота ( III) N 2 O 3 и оксид азота (V) N 2 O 5 растворяются в воде с образованием соответствующих кислот.
N 2 O 3 + H 2 O = 2HNO 2
N 2 O 5 + H 2 O = 2HNO 3
Назовите кислоты и соли, соответствующие данным кислотам .
Азотистая кислота → нитриты
Азотная кислота → нитраты

Свойства оксида азота ( IV)
Оксид азота ( IV) NO 2 является смешанным оксидом. При взаимодействии его с водой, образуются две кислоты .
2NO 2 + H 2 O = HNO 2 + HNO 3
При взаимодействии NO 2 с водой в присутствии кислорода образуется только азотная кислота.
4 NO 2 + 2 H 2 O + О 2 = 4 HNO 3
При растворении оксида в щелочи, образуются две соли.
2NO 2 + 2NaOH = NaNO 2 + NaNO 3 + H 2 O

Применение оксидов .
Оксид азота ( II) NO и оксид азота ( IV) NO 2 используют для получения азотной кислоты.
В промышленности NO получают каталитическим окислением аммиака : 4NH 3 + 5O 2 → 4NO +6H 2 О
NO 2 в промышленности получают путем окисления оксида азота ( II) кислородом: 2 NO + O 2 → 2 NO 2
Оксид азота ( I ) N 2 O в смеси с кислородом используется в медицине для наркоза («веселящий газ»).
N 2 O получают разложением нитрата аммония:
NH 4 NO 3 → N 2 O + 2H 2 O

HNO 3
Бесцветная, дымящая на воздухе жидкость.
Сильная кислота. Под действием света разлагается на оксид азота ( IV ), воду и кислород.
Химические свойства азотной кислоты
оксид металла → соль + вода
HNO 3 основание → соль + вода
соль → соль + кислота
металл → соль + вода + Х

Урок №2
Цель урока для обучающихся: изучить свойства азотной кислоты как окислителя; познакомиться с особенностями разложения нитратов и их применением.

HNO 3
- сильный окислитель.
HNO 3 + металл → соль + вода + Х
Концентрированная
Разбавленная
Пассивирует: Al, Fe, Cr, Au, Pt
С тяжелыми металлами - NO 2
С тяжелыми металлами - NO
С активными металлами – N 2 O
С активными металлами – N Н 3 , N 2
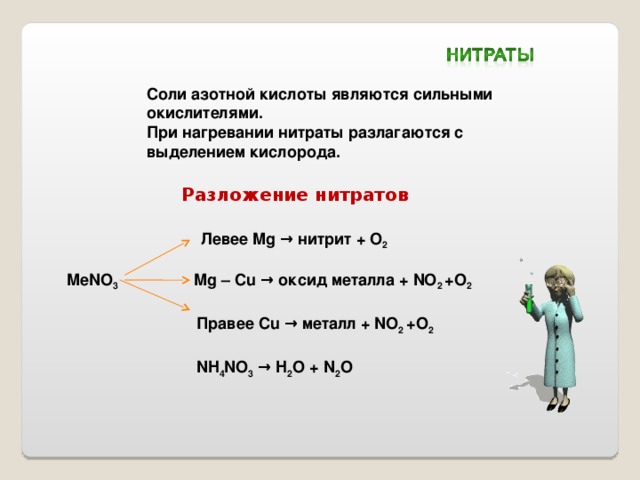
Соли азотной кислоты являются сильными окислителями.
При нагревании нитраты разлагаются с выделением кислорода.
Разложение нитратов
Левее Mg → нитрит + O 2
MeNO 3 Mg – Cu → оксид металла + NO 2 +O 2
Правее Cu → металл + NO 2 +O 2
NH 4 NO 3 → H 2 O + N 2 O

Применение соединений азота.
Получение, лаков, кинопленок , азотных удобрений, лекарственных веществ - HNO 3
A зотны e удобрения - NaNO 3 , KNO 3 , NH 4 NO 3
Текстильная промышленность - Cu(NO 3 ) 2 , Fe(NO 3 ) 2
Медицина - AgNO 3
Пиротехника - Ba(NO 3 ) 2 , Pb(NO 3 ) 2
Изготовление взрывчатых веществ - NaNO 3 , KNO 3 , NH 4 NO 3

Химию знать полезно!































