
Al 2 (SO 4 ) 3 + KOH(нед) =
Al 2 (SO 4 ) 3 + KOH(изб.) =
1.Al 2 (SO 4 ) 3 + 6KOH (нед.) = 2AL(OH) 3 +3K 2 SO 4
2. Al 2 (SO 4 ) 3 + 8KOH (изб) = 2KAlO 2 + 3K 2 SO 4 + 4H 2 O

Al AlCl 3 Al(OH) 3 Al 2 O 3 NaAlO 2 Al 2 (SO 4 ) 3 Al(OH) 3 AlCl 3 NaAlO 2
- 2Al +3Cl 2 = 2AlCl 3
- AlCl 3 + 3NaOH =Al(OH) 3 + 3NaCl
- 2Al(OH) 3 = Al 2 O 3 + 3H 2 O
- Al 2 O 3 +2NaOH =2NaAlO 2 + H 2 O
- 2NaAlO 2 + 4H 2 SO 4(изб.) = Na 2 SO 4 + Al 2 (SO 4 ) 3 +4H 2 O
- Al 2 (SO 4 ) + 6NaOH = 2Al (OH) 3 + 3Na 2 SO 4
- Al(OH) 3 +3HCl =AlCl 3 + 3H 2 O
- AlCl 3 + 4NaOH (избыт.) = NaAlO 2 + 3NaCl + 2H 2 O

Железо и его соединения
« Железо не только основа всего мира, самый
главный металл окружающей нас природы,
оно – основа культуры и промышленности,
оно – орудие войны и мирного труда.
И трудно во всей таблице Менделеева
найти другой элемент, который был бы так связан
с прошлым, настоящим и будущими
судьбами человечества.»
А. Е. Ферсман.

Цель урока : Рассмотреть электронное строение атома железа, дать его общую характеристику. Изучить физические и химические свойства. Рассмотреть важнейшие соединения железа (ll) и (lll). Ознакомиться с природными соединениями железа и с качественными реакциями на ионы железа (ll) и (lll).

Из истории железа…
«Железо» от санскритского «жель»-блестеть, пылать


Нахождение железа в природе
Fe 2 O 3
Гематит
FeS 2
Пирит
Fe 3 O 4
Магнетит
2-ой по распространенности металл после Al (5,1%)
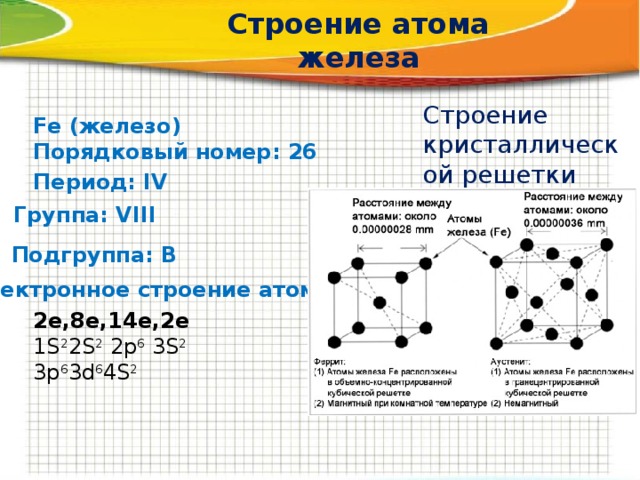
Строение атома железа
Строение кристаллической решетки железа
Fe (железо)
Порядковый номер: 26
Период: IV
Группа: VIII
Подгруппа: В
Электронное строение атома:
2е,8е,14е,2е
1S 2 2S 2 2p 6 3S 2 3p 6 3d 6 4S 2



Химические свойства железа:
1.Взаимодействие с простыми веществами(при t°) :
А) с галогенами: 2Fe + 3Cl 2 →2FeCl 3
Б) с кислородом: 3Fe + 3O 2 →Fe 3 O 4
В) с серой: Fe + S → FeS
2. Взаимодействие со сложными веществами:
А) с кислотами (HCl ,разб. H 2 SO 4 )
Fe +2 HCl → FeCl 2 + H 2↑
Б) с солями
Fe + CuSO 4 → Cu + FeSO 4
В) с водой (при t)
3Fe +4H 2 O→ Fe 3 O 4 +4 H 2↑
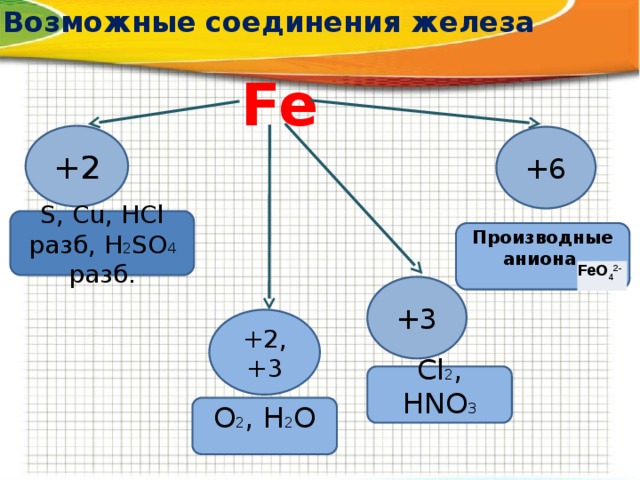
Возможные соединения железа
Fe
+2
+6
S, Cu, HСl разб, H 2 SO 4 разб.
Производные аниона
FeO 4 2-
+3
+2, +3
Cl 2 , HNO 3
O 2 , H 2 O

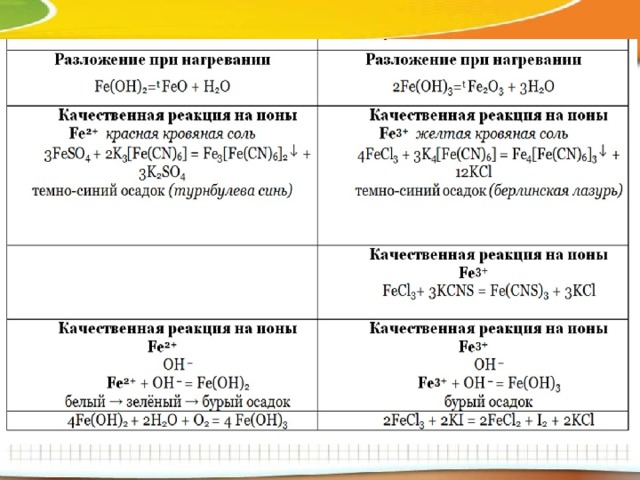
Качественные реакции на ионы Fe2+, Fe3+

Получение гидроксидов железа
FeCI₂ + 2NaOH = Fe(OH)₂↓ +2NaCI
FeCI₃ + 3NaOH = Fe(OH)₃↓ + 3NaCI
Fe(OH)₂ окисляется на воздухе: сначала зеленеет, потом приобретает бурую окраску
4Fe(OH)₂ + 2H₂O + O₂ = 4Fe(OH)₃↓
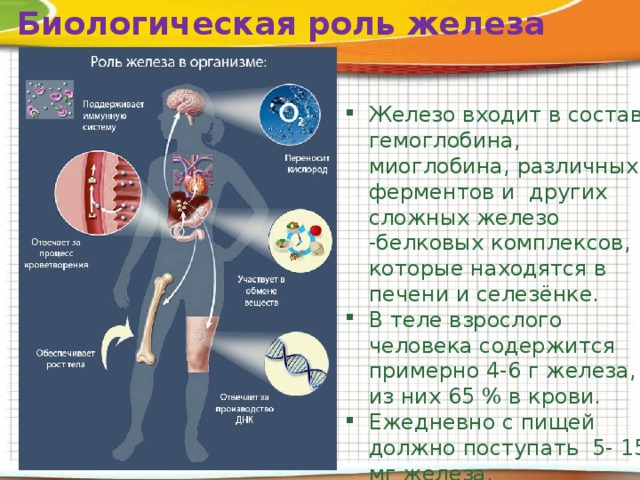
Биологическая роль железа
- Железо входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо -белковых комплексов, которые находятся в печени и селезёнке.
- В теле взрослого человека содержится примерно 4-6 г железа, из них 65 % в крови.
- Ежедневно с пищей должно поступать 5- 15 мг железа.

Генетический ряд Fe +2
FeО FeCl 2 Fe(OH) 2 FeO
Генетический ряд Fe +3
Fe 2 О 3 FeCl 3 Fe(OH) 3 Fe 2 O 3
FeO
Fe(OH) 2
Fe(OH) 3
Fe 2 О 3


































